Tampilkan postingan dengan label kimia farmasi. Tampilkan semua postingan
Tampilkan postingan dengan label kimia farmasi. Tampilkan semua postingan
Jumat, 30 September 2011
Awas! Alkohol Bukan untuk Luka
Apa yang biasa Anda lakukan saat si kecil jatuh dari sepeda dan lututnya berdarah? Kebanyakan ibu langsung mencari alkohol untuk membersihkan luka tersebut. Meskipun anak Anda mengeluh perih, dengan yakin Anda berkata bahwa cara tersebut sudah yang paling manjur menyembuhkan luka. Padahal tak jarang cara-cara tersebut hanyalah mitos. Alkohol selama ini diyakini mampu mensterilkan area luka dan mempercepat proses penyembuhan luka. Hmm.. apa benar begitu?
Faktanya, menggunakan alkohol atau hydrogen peroxide untuk membersihkan luka justru akan merusak jaringan kulit dan menghambat proses penyembuhan. Memang benar alkohol dapat membantu membunuh bakteri, tapi tidak hanya bakteri saja yang terbunuh melainkan juga sel-sel di sekitar area luka. Itulah kenapa, sebenarnya, proses penyembuhan luka malah akan bertambah lama. Bagaimana kulit baru dapat tumbuh dengan cepat kalau sel-selnya mati? Jika Anda mengaku alkohol membantu luka sembuh dengan cepat, mungkin itu sekadar sugesti Anda saja.
Cara terbaik membersihkan luka kecil adalah membasahinya dengan air mengalir dan sabun biasa (tak perlu menggunakan sabun antiseptik khusus). Lalu keringkan luka setidaknya lima menit untuk menghilangkan kotoran, serpihan benda asing, dan berikan salep antibiotik untuk menghindari infeksi dari bakteri. Namun untuk luka yang menganga lebar, dalam, dan terus menerus berdarah harus diobati oleh orang yang ahli.
Dr.Oz di acara OPRAH SHOW juga mengingatkan masyarakat untuk mengganti alkohol dengan 'air garam hangat'. Larutkan garam dalam air bersuhu hangat dan basuh kaki Anda dengan air tersebut. Air garam mampu membunuh kuman-kuman di area luka dan ternyata sel-sel di tubuh kita pun 'menyukai' kandungan garam tersebut. Jika sudah begitu, dipastikan proses kesembuhan juga akan berlangsung lebih cepat.
Nah, ternyata cara terbaik menangani luka justru datang dari hal-hal mudah di sekitar kita. Cukup dengan air, sabun, dan garam saja Anda mampu menjadi perawat bagi si kecil yang cedera. Untungnya lagi, kini Anda tak perlu repot mendiamkan anak Anda yang berteriak histeris saat alkohol menyentuh lukanya
sumber : KapanLagi.com -
Kamis, 29 September 2011
METABOLISME XENOBIOTIK
APA ITU XENOBIOTIK
- Xenobiotik berasal dari bahasa Yunani: Xenos yang artinya asing
- Xenobiotik adalah zat asing yang masuk dalam tubuh manusia
- Contoh: obat obatan, insektisida, zat kimia tambahan pada makanan (pemanis, pewarna, pengawet) dan zat karsinogen lainya
MENGAPA XENOBIOTIK DI METABOLISME
- Xenobiotik umumnya tidak larut air, sehingga kalau masuk tubuh tidak dapat diekskresi
- Untuk dapat diekskresi xenobiotik harus dimetabolisme menjadi zat yang larut, sehingga bisa diekskresi
- Organ yang paaling berperan dalam metabolisme xenobiotik adalah hati
- Ekskresi xenobiotik melalui empedu dan urine
METABOLISME XENOBIOTIK
- Metabolisme xenobiotik dibagi 2 fase
- Fase Hidroksilasi dan Fase Konjugasi
- Fase Hidroksilasi → fase mengubah xenobiotik aktif menjadi inaktif
- Fase konjugasi → fase mereaksikan xenobiotik inaktik dengan zat kimia tertentu dalam tubuh menjadi zat yang larut, sehingga mudah diekresi baik lewat empedu maupun urine
- Fase Hidroksilasi → fase mengubah xenobiotik aktif menjadi inaktif, oleh enzim Mono oksidase atau Sitokrom P450
- Enzim Sitokrom P450 terdapat banyak di Retikulum Endoplasma
- Fungsi enzim ini adalah sebagai katalisator perubahan Hidrogen (H) pada xenobiotik menjadi gugus Hidroksil (OH)
- Reaksi Hidroksilasi oleh enzim Sitokrom P450 adalah sbb:
- RH + O2 → R-OH + H2O
- Sitokrom P450 merupakan hemoprotein seperti Hemoglobin, banyak terdapat pada membran retikulum endoplasma sel hati
- Pada beberapa keadaan produk hidroksilasi bersifat mutagenik atau karsinogenik
- Fase konjugasi → fase mereaksikan xenobiotik inaktik dengan zat kimia tertentu dalam tubuh menjadi zat yang larut, sehingga mudah diekskresi baik lewat empedu maupun urine
- Zat dalam tubuh yang biasa dipergunakan untuk proses konjugasi adalah: asam glukoronat, sulfat, acetat, glutation atau asam amino tertentu
- Glukuronidasi: proses menkonjugasi xenobiotik dengan asam glukorunat, dengan enzim glukuronil transferase
- Xenobiotik yang mengalami glukorunidasi adalah: asetilaminofluoren (karsinogenik), anilin, asam benzoat, meprobamat, fenol dan senyawa steroid
- Sulfasi: proses konjugasi xenobiotik dengan asam sulfat, dengan enzim sulfotransferase
- Xenobiotik yang mengalami sulfasi adalah: alkohol, arilamina, fenol
- Konjugasi dengan Glutation, yang terdiri dari tripeptida (glutamat, sistein, glisin) dan biasa disingkat GSH, menggunakan enzim glutation S-transferase atau epoksid hidrolase
- Xenobiotik yang berkonjugasi dengan GSH adalah xenobiotik elektrofilik (karsinogenik)
- Metabolisme xenobiotik kadang disebut proses detoksifikasi, tetapi istilah ini tidak semuanya benar, sebab tidak semua xenobiotik bersifat toksik
- Respon metabolisme xenobiotik mencakup efek farmakologik, toksik, imunologik dan karsinogenik
METABOLISME XENOBIOTIK OBAT
- Pada metabolisme obat, pada obat yang sudah aktif → metabolisme xenobiotik fase 1 berfungsi mengubah obat aktif menjadi inaktif, sedang paa obat yang belum aktif → metabolisme xenobiotik fase 1 berfungsi mengubah obat inaktif menjadi aktif
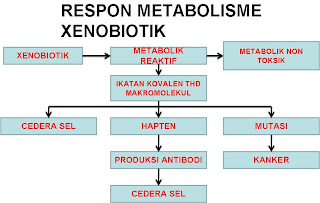
RESPON METABOLISME XENOBIOTIK
- Respon metabolisme xenobiotik dapat menguntungkan karena metabolit yang dihasilkan menjadi zat yang polar sehingga dapat diekskresi keluar tubuh
- Respon metabolisme xenobiotik dapat merugikan karena:
- Berikatan dengan makromolekul dan menyebabkan cidera sel
- Berikatan dengan makromolekul menjadi hapten → merangsang pembentukan antibodi dan menyebakan reaksi hipersensitivitas yang berakibat cidera sel
- Berikatan dengan makromolekul menjadi zat mutan yang menyebakan timbulnya sel kanker
REFERENSI
- Harper, Rodwell, Mayes, 1977, Review of Physiological Chemistry
- Colby, 1992, Ringkasan Biokimia Harper, Alih Bahasa: Adji Dharma, Jakarta, EGC
- Wirahadikusumah, 1985, Metabolisme Energi, Karbohidrat dan Lipid, Bandung, ITB
- Harjasasmita, 1996, Ikhtisar Biokimia Dasar B, Jakarta, FKUI
- Toha, 2001, Biokimia, Metabolisme Biomolekul, Bandung, Alfabeta
- Poedjiadi, Supriyanti, 2007, Dasr-Dasar Biokimia, Bandung, UI Press
- dr-suparyanto.blogspot.com
Label:
biologi,
farmakologi,
keperawatan,
kesehatan,
kimia farmasi,
mikrobiologi,
obat,
Pengetahuan,
sosial,
umum
PEMERIKSAAN AIR SENI (URINE ANALYSIS)
Dr, Suparyanto, M.Kes
JENIS URINE
PENGAMBILAN URINE
WADAH
VOLUME
WARNA URINE
Prinsip:
Tujuan:
Persiapan:
Alat yang diperlukan: tabung reaksi
Cara pemeriksaan:
Pelaporan:
KEJERNIHAN
Cara pemeriksaan:
PEMERIKSAAN BERAT JENIS URINE
Cara pemeriksaan:
Perhitungan:
PEMERIKSAAN DERAJAT KEASAMAN URINE
Cara pemeriksaan:
PEMERIKSAAN SEDIMEN URINE
Cara pemeriksaan:
Hasil yang mungkin ditemukan:
PEMERIKSAAN PROTEIN URINE
Cara pemeriksaan:
Hasil:
PEMERIKSAAN BILIRUBINE URINE
Alat yang digunakan:
Cara pemeriksaan
PEMERIKSAAN REDUKSI URINE
Alat yang digunakan:
Cara pemeriksaan (Metode Benedict):
Hasil:
PEMERIKSAAN GALLI MAININI TEST
Alat yg digunakan:
PEMERIKSAAN TES KEHAMILAN IMUNOLOGIK
Alat yg diperlukan:
REFERENSI
JENIS URINE
- Urine sewaktu: urine yang dikeluarkan pada waktu yang tidak ditentukan (sewaktu-waktu)
- Untuk pemeriksaan warna, kejernihan, bilirubin, pH
- Urine pagi: urine yang dikeluarkan pd waktu pagi hari setelah bangun tidur
- Untuk pemeriksaan: berat jenis, protein, sedimen
PENGAMBILAN URINE
WADAH
- Bermulut lebar dan dapat ditutup rapat
- Harus bersih dan kering
- Wadah diberi label: nama, nomor dan tanggal
VOLUME
- 20 ml, kecuali untuk berat jenis = 50 ml
- Harus segera diperiksa, jika ditunda simpan di lemari es (4oC), atau dalam termos es
WARNA URINE
Prinsip:
- warna urine diuji pada ketebalan 7-10cm dengan cahaya tembus
Tujuan:
- mengetahui warna urine
Persiapan:
- Px dilarang makan/minum obat yang memberi warna urine: B-komplek, rifampisin, piramidon dll
Alat yang diperlukan: tabung reaksi
Cara pemeriksaan:
- Isi tabung reaksi dengan urine ¾ nya
- Dilihat dlm posisi miring dng penerangan matahari
Pelaporan:
- Tidak berwarna, kuning muda, kuning kemerahan, putih susu
- Nilai normal: kuning muda – kuning tua
KEJERNIHAN
- Prinsip: memeriksa kejernihan urine secara langsung
- Tujuan: menentukan apakah urine telah keruh pada saat dikeluarkan atau setelah didiamkan
- Persiapan: pasien jangan terlalu banyak makan protein
Cara pemeriksaan:
- Masukan urine kedlm tabung reaksi, ¾ nya
- Dilihat dng latar belakang hitam, dengan sinar matahari
- Dilihat kejernihanya, apakah ada kekeruhan
- Pelaporan: jernih, agak keruh, keruh atau sangat keruh
- Nilai normal: Tidak berwarna/jernih
PEMERIKSAAN BERAT JENIS URINE
- Prinsip: memeriksa berat jenis urine dengan alat urinometer
- Tujuan: mengetahui kepekatan urine
- Alat yang diperlukan:
- Urinometer
- Gelas ukur 50 ml
- Termometer 0o-50oc
Cara pemeriksaan:
- Baca dan catat suhu tera yang tercantum pada alat urinometer, kemudian baca suhu kamar
- Tuang urine ke gelas ukur 50 cc
- Masukan urinometer kedlm gelas ukur, usahakan bebas terapung
- Baca berat jenis setinggi miniskus bawah (3 angka dibelakang koma)
Perhitungan:
- Jika suhu urinometer berbeda dengan suhu kamar, lakukan koreksi → perbedaan 3oC, suhu kamar melebihi sushu tera → berat jenis ditambah 0,001, dibawahnya dikurangi 0,001
- Contoh: suhu tera 30oC, urine 33oC → urinometer 1,004 → berat jenis urine 1,004 + 0,001 = 1,005
- Nilai normal: 1,003 – 1,030
PEMERIKSAAN DERAJAT KEASAMAN URINE
- Prinsip: perubahan warna kertas lakmus dalam suasana keasaman tertentu
- Tujuan: mengetahui pH urine
- Alat yang dipakai: kertas lakmus merah – biru
Cara pemeriksaan:
- Kertas lakmus merah atau biru dibasahi urine
- Tunggu 1 menit, perhatikan perubahan warna yang terjadi
- Urine asam: lakmus biru → merah
- Urine basa: lakmus merah → biru
- Urine netral: lakmus merah/biru tidak berubah warna
PEMERIKSAAN SEDIMEN URINE
- Prinsip: Berat jenis unsur organik – anorganik > BJ urine → dengan sentrifuge zat-zat tsb akan mengendap
- Tujuan: menentukan unsur sedimen organik – anorganik dlm urine secara mikroskopis
- Persiapan px: dilarang makan obat sulfa
Cara pemeriksaan:
- Kocok urine dalam botol agar sedimen merata
- Masukan urine dalam tabung sentrifuge 10 –15 cc → sentrifuge selama 5 menit dengan kecepatan 2000 rpm
- Tuang bagian atas urine → tinggal 0,5 – 1 cc → kocok kembali sedimen
- Tuang dalam obyek glass, tutup dengan cover glass → periksa dibawah mikroskop
Hasil yang mungkin ditemukan:
- Sel epitel, eritrosit, lekosit, silinder, kristal, jamur, trikomonas, spermatozoa
- Eritrosit: 0 – 1 / LP
- Leukosit: 0 – 3 / LP
- + : bila jumlahnya sedikit
- ++ : bila jumlahnya banyak
- +++ : bila jumlahnya banyak sekali
PEMERIKSAAN PROTEIN URINE
- Prinsip: terjadi endapan urine jika direaksikan dengan asam sulfosalisilat
- Tujuan; menentukan adanya protein dalam urine
- Alat yang diperlukan:
- Tabung reaksi dan rak
- Pipet
Cara pemeriksaan:
- 2 tabung reaksi A & B diisi urine 2cc
- Tabung A + 8 tetes asam sulfosalisilat 20 % → goyang perlahan agar campur
- Kekeruhan dilihat dengan latar belakang gelap, bandingkan dengan tabung B
Hasil:
- Negatif : tidak ada kekeruhan
- Positif + : kekeruhan ringan tanpa butiran
- Positif ++ : kekeruhan dengan butiran
- Positif +++ : kekeruhan dengan kepingan
- Positif ++++ : kekeruhan dengan gumpalan
PEMERIKSAAN BILIRUBINE URINE
- Prinsip: oksidasi pigmen empedu oleh asam → biliverdin (hijau) atau bilisianin (biru) atau choletelin (ungu)
- Tujuan; mengetahui adanya bilirubin dalam urine
- Persiapan px; dilarang minum obat pyridin
Alat yang digunakan:
- Corong kaca,
- Kertas saring,
- Tabung reaksi dan rak
- Reagen:
- Barium klorit 10 %
- Reagen Fouchet
Cara pemeriksaan
- Masukan urine dlm tabung reaksi 5cc + 5cc barium klorit 20 %
- Campur lalu saring dengan kertas saring
- Kertas saring dengan endapan dikeringkan
- Tetesi endapan dengan reagen fouchet 2-3 tetes
- Perhatikan perubahan warna
- Hasil:
- Positif : ada warna hijau
- Negatif : tidak ada warna hijau
PEMERIKSAAN REDUKSI URINE
- Prinsip: glukosa dapat mereduksi ion cupri dalam larutan alkalis → terjadi perubahan warna dari hijau → merah
- Tujuan: menentukan adanya glukose dalam urine
- Persiapan px:
- Dilarang minum obat vit.C, salisilat, sterptomisin → memberi hasil positif palsu
Alat yang digunakan:
- Tabung reaksi
- Pipet
- Lampu spiritus
- Penjepit tabung
- Reagen:
- Fehling
- Benedict
Cara pemeriksaan (Metode Benedict):
- Masukan 2,5cc reagen benedict kedlm tabung reaksi
- Tambahkan urine 4 tetes
- Panaskan dalam air mendidih 5 menit atau dengan api spiritus 2 menit, jaga jangan sampai mendidih
- Angkat tabung dan baca hasilnya
Hasil:
- Negatif : tetap biru atau kehijauan
- Positif +: hijau kekuningan keruh
- Positif ++: kuning keruh
- Positif +++: Jingga atau lumpur keruh
- Positif ++++: Merah bata keruh
PEMERIKSAAN GALLI MAININI TEST
- Prinsip: menemukan spermatozoa dlm urine katak jantan yg dirangsang oleh HCG urine
- Tujuan: mengetahui kehamilan dng menggunakan katak jantan
- Persiapan: katak jantan yg dipergunakan tidak boleh mengandung sperma → dng pipet diambil cairan di lubang pengeluaran → periksa mikroskop → jika ada sperma tidak boleh dipakai
Alat yg digunakan:
- Spuit 5cc, Kaca obyek, Mikroskop
- Urine 5cc disuntikan sc di perut 1 ½ cm didepan cloaca → lepas ditoples berisi air
- 1 jam kmdn → periksa urine katak, jika tdk ada sperma → periksa 1 jam lagi
- Jika ada sperma GM (+), jika tidak GM (-)
PEMERIKSAAN TES KEHAMILAN IMUNOLOGIK
- Tujuan: untuk mengetahui kehamilan dengan tes serologi
- Prinsip:
- Reaksi hambatan aglutinasi antara antibodi HCG dengan lateks (reagen) oleh HCG
- Lateks akan diendapkan oleh antibodi HCG
- Adanya HCG bebas dalam urine → antibodi akan dinetralkan → sehingga pengendapan tidak terjadi
Alat yg diperlukan:
- Kaca obyek, pipet, pengaduk
- Antibodi HCG serum, HCG-lateks (antigen)
- 1 tetes urine + 1 tetes anti serum → pada kaca obyek →aduk
- Tambah 1 tetes antigen → goyang → baca
- Positif: tidak ada penggumpalan
- Negatif: ada penggumpalan
REFERENSI
- Harper, Rodwell, Mayes, 1977, Review of Physiological Chemistry
- Colby, 1992, Ringkasan Biokimia Harper, Alih Bahasa: Adji Dharma, Jakarta, EGC
- Wirahadikusumah, 1985, Metabolisme Energi, Karbohidrat dan Lipid, Bandung, ITB
- Harjasasmita, 1996, Ikhtisar Biokimia Dasar B, Jakarta, FKUI
- Toha, 2001, Biokimia, Metabolisme Biomolekul, Bandung, Alfabeta
- Poedjiadi, Supriyanti, 2007, Dasr-Dasar Biokimia, Bandung, UI Press
- Depkes, 1991, Petunjuk Pemeriksaan Laboratorium Puskesmas,Jakarta,Depkes
Label:
alat kesehatan,
farmakologi,
kimia farmasi,
mikrobiologi,
Pengetahuan,
penyakit,
sosial,
umum
Senin, 26 September 2011
PEMERIKSAAN DARAH (BLOOD ANALYSIS)
Dr; Suparyanto, M.Kes
PENGAMBILAN SPESIMEN
PEMERIKSAAN HEMOGLOBIN METODE SAHLI
Cara pemeriksaan:
Cara pemeriksaan:
PEMERIKSAAN HITUNG LEUKOSIT
Cara pemeriksaan:
PEMERIKSAAN HITUNG ERITROSIT
Cara pemeriksaan:
Nilai Normal:
PEMERIKSAAN HITUNG TROMBOSIT
Cara pemeriksaan:
PEMERIKSAAN LAJU ENDAP DARAH (LED)
PEMERIKSAAN HITUNG JENIS LEUKOSIT
Reagen:
Harga Normal:
PEMERIKSAAN GOLONGAN DARAH ABO
Reagen:
Hasil:
GOL. DARAH ANTI A ANTI B
A + -
B - +
AB + +
O - -
WAKTU PERDARAHAN
(BLEEDING TIME)
Prinsip :
WAKTU PEMBEKUAN
(CLOTING TIME)
Prinsip :
PEMERIKSAAN PAPANICOLAOU SMEAR
Prinsip :
Hasil:
PEMERIKSAAN JAMUR
Prinsip :
PEMERIKSAAN SEREBRO SPINAL
Volume :
Putih / mm3 Merah / mm3
Neonatus 0.15 0.5
Anak 0.10 0.1
Dewasa 0.5 0.1
Chlorida :
Glukosa :
REFERENSI
PENGAMBILAN SPESIMEN
- Alat: pipet, spuit, lancet, tourniquet, kapas alkohol 70%
- Wadah: tertutup, bersih, kering, berlabel
- Dewasa: ujung jari tengah, manis
- Anak: tumit, ibu jari kaki bag pinggir
- Darah vena: vena cubiti
- EDTA (Ethylene Diamine Tetra Acetate) → 1½ mg/ml
- Larutan Oxalat → 0,2 ml/ml darah
PEMERIKSAAN HEMOGLOBIN METODE SAHLI
- Prinsip: Hb → asam hematin (oleh HCl) → warna as hematin dibandingkan dengan standart
- Tujuan: menetapkan kadar Hb dlm darah
- Reagen: lar HCl 0,1N, aquadest
- Gelas berwarna sbg standart
- Tabung hemometer
- Pengaduk dari gelas
- Pipet Sahli, pipet Pasteur
- Kertas saring
Cara pemeriksaan:
- Tab hemometer diisi lar HCl 0,1N → sampai tanda 2
- Hisap darah kapiler dng pipet Sahli smpi tanda 20 μl
- Hapus kelebihan darah dng kertas tisu
- Masukan darah kedalam tabung hemometer
- Bilas darah dengan larutan HCl didlm tabung
Cara pemeriksaan:
- Tunggu 5 menit → pembentukan as. Hematin
- Tambah aquadest → sampai warna sama dengan standart → baca dalam gr/dl
- Laki-laki: 14 – 18 gr/dl
- Wanita : 12 – 16 gr/dl
PEMERIKSAAN HITUNG LEUKOSIT
- Prinsip: darah diencerkan dan dicat dengan larutan Turk → lalu dihitung jumlah leukosit dalam volume tertentu
- Tujuan: menghitung jumlah lekosit dalam darah
- Alat yg digunakan:
- Pipet leukosit
- Kamar hitung (Improved Neubauer)
- Mikroskop
- Counter tally
- Reagen: Larutan Turk
Cara pemeriksaan:
- Hisap darah EDTA dng pipet lekosit → sampai tanda 0,5
- Hapus kelebihan darah dng kertas tisu
- Hisap lar. Turk sampai tanda 11
- Kocok darah dan larutan ± 2 – 3 menit
- Buang lar 3 – 4 tetes → masukan kedalam kamar hitung
- Hitung leukosit dengan mikroscop → lap 1,3,7,9 → hasil x 50
- Nilai Normal: 5.000 – 10.000 / mm3
PEMERIKSAAN HITUNG ERITROSIT
- Prinsip: darah diencerkan dan dicat dengan larutan Hayem → lalu dihitung jumlah eritrosit dalam volume tertentu
- Tujuan: menghitung jumlah eritrosit dalam darah
- Alat yg digunakan:
- Pipet eritrosit
- Kamar hitung (Improved Neubauer)
- Mikroskop
- Counter tally
- Reagen: Larutan Hayem
Cara pemeriksaan:
- Hisap darah EDTA dng pipet eritrosit → sampai tanda 0,5
- Hapus kelebihan darah dng kertas tisu
- Hisap lar. Hayem sampai tanda 101
- Kocok darah dan larutan ± 2 – 3 menit
- Buang lar 3 – 4 tetes → masukan kedalam kamar hitung
- Hitung leukosit dengan mikroscop → lap A, B, C, D dan E → hasil x 10.000
Nilai Normal:
- Pria : 4,5 – 5,5 juta/ mm3
- Wanita : 4 – 5 juta/ mm3
PEMERIKSAAN HITUNG TROMBOSIT
- Prinsip: darah diencerkan dan dicat dengan larutan Rees Echer → lalu dihitung jumlah trombosit dalam volume tertentu
- Tujuan: menghitung jumlah trombosit dalam darah
- Alat yg digunakan:
- Pipet eritrosit
- Kamar hitung (Improved Neubauer)
- Mikroskop
- Counter tally
- Reagen: Larutan Rees Ecker
Cara pemeriksaan:
- Hisap darah EDTA dng pipet lekosit → sampai tanda 0,5
- Hapus kelebihan darah dng kertas tisu
- Hisap lar. Rees Echer sampai tanda 101
- Kocok darah dan larutan ± 2 – 3 menit
- Buang lar 3 – 4 tetes → masukan kedalam kamar hitung
- Hitung trombosit dengan mikroscop → lap 1,3,7,9 → hasil x 500
- Nilai Normal: 150.000 – 400.000 / mm3
PEMERIKSAAN LAJU ENDAP DARAH (LED)
- Prinsip (Cara Westergren) →darah EDTA didiamkan dlm waktu tertentu, maka sel sel darah akan mengendap
- Tujuan: Untuk mengetahui kecepatan eritrosit mengendap dalam waktu tertentu
- Alat yang digunakan:
- Tabung Westergren
- Rak Westergren
- Penghisap
- Pencatat waktu
- Pipet berskala
- Spuit 5cc
- Botol kecil
- Reagen: Natrium sitrat 3,8%
- Sediakan botol yang telah diberi 0,4cc Na Sitrat 3,8%
- Hisap darah vena 1,6cc dan masukan kedalam botol yg telah diisi Na sitrat 3,8%
- Campur baik-baik
- Hisap campuran tsb kedlm tab Westergren → sampai tanda 0
- Biarkan pipet tegak lurus dalam rak Westergren
- Baca tingginya plasma selama 1 dan 2 jam
- Laki-laki : 0 – 10 mm/jam
- Wanita : 0 – 20 mm/jam
PEMERIKSAAN HITUNG JENIS LEUKOSIT
- Prinsip: terdapat perbedaan daya serap terhadap zat asam
- Tujuan: menghitung jumlah tiap-tiap jenis leukosit dalam darah
- Alat yang digunakan:
- Mikroskop
- Obyek glass
- Lancet steril
- Pencatat waktu
- Rak pengecatan
- Rak pengering
- Minyak imersi
- Kaca penggeser
- Pinsil kaca
Reagen:
- Larutan Wright
- Larutan buffer pH 6,4
- Buat hapusan darah tepi
- Cat hapusan dengan lar. Wright → 2 menit
- Tetesi dengan lar buffer sama banyak → selama 5 menit
- Siram dengan aquadest
- Keringkan dan baca dengan mikroskop
Harga Normal:
- Eosinofil : 1 – 3 %
- Basofil : 0 – 1 %
- Batang : 2 – 6 %
- Segmen : 50 – 70 %
- Limfosit : 20 – 40 %
- Monosit : 2 – 8 %
PEMERIKSAAN GOLONGAN DARAH ABO
- Prinsip: aglutinasi sel darah merah dengan anti serum tertentu
- Tujuan: untuk mengetahui golongan darah seseorang
- Alat yang diperlukan:
- Obyek glass
- Lancet
- Kapas alkohol
Reagen:
- Serum anti A, Serum anti B, Serum anti AB
- Taruh pada masing-masing obyek glass serum anti A, B dan AB
- Tetesi serum dengan darah dan aduk
- Lihat penggumpalan yang terjadi
Hasil:
GOL. DARAH ANTI A ANTI B
A + -
B - +
AB + +
O - -
WAKTU PERDARAHAN
(BLEEDING TIME)
Prinsip :
- Ialah pemeriksaan terhadap fungsi pembuluh darah (kapilaria) jumlah dan fungsi trombosit (ekstrinsik faktor)
- Cuping telinga ditusuk pinset → dihitung sampai darah berhenti
WAKTU PEMBEKUAN
(CLOTING TIME)
Prinsip :
- Dengan pemeriksaan waktu pembekuan dapat dilihat adanya kelainan / kekurangan dari faktor intrinsik
- Darah dimasukan tabung reaksi → dihitung waktunya sampai beku
PEMERIKSAAN PAPANICOLAOU SMEAR
Prinsip :
- Mendeteksi adanya sel sel ganas pada hapusan sekret vagina / servik
- Px tidak boleh irigasi vagina, memasukan obat pervagina, tidak coitus 24 – 48 jam sebelumnya
- Pemeriksaan dilakukan diantara waktu mens dengan posisi litotomi
- Dengan spekulum, ambil permukaan servik dengan spatula → bahan difiksasi dlm obyek glass
Hasil:
- Kelas 1: tidak ada sel atipikal/abnormal
- Kelas 2: sel atipikal, tidak terbukti maligna
- Kelas 3: dugaan, tp tdk disimpulkan maligna
- Kelas 4: dugaan kuat maligna
- Kelas 5: kesimpulan maligna
PEMERIKSAAN JAMUR
Prinsip :
- Larutan KOH 10 % atau 20 % akan melisiskan kulit, rambut, kuku sehingga bila mengandung jamur akan terlihat adanya Hypha atau spora
PEMERIKSAAN SEREBRO SPINAL
- Cairan serebro spinal diperoleh dari lumbal pungsi pada ruang antar lumbal L3-4 atau L4-5.
- Tekanan pertama diukur, kemudian cairan diaspirasi dan dimasukan dalam tabung pemeriksaan yang steril.
- Data analisa cairan spinal sangat penting dalam mendiagnosa penyakit medulla spinalis dan otak
Volume :
- Bayi : 40 – 60 ml
- Anak : 80 – 120 ml
- Dewasa : 100 – 160 ml
Putih / mm3 Merah / mm3
Neonatus 0.15 0.5
Anak 0.10 0.1
Dewasa 0.5 0.1
Chlorida :
- Neonatus : 108 – 122 mmol / l
- Dewasa : 112 – 130 mmol / l
Glukosa :
- Neonatus : 1.1 – 2.2 mmol / l
- Bayi/anak : 3.9 – 5.0 mmol / l
- Dewasa : 2.8 – 4.4 mmol / l
- Protein Total : 15 – 45 mg / 100 ml
- Albumin : 52 %
- Alpha 1 globulin : 5 %
- Alpha 2 globulin : 14 %
- Beta globulin : 10 %
- Gamma globulin : 19 %
REFERENSI
- Harper, Rodwell, Mayes, 1977, Review of Physiological Chemistry
- Colby, 1992, Ringkasan Biokimia Harper, Alih Bahasa: Adji Dharma, Jakarta, EGC
- Wirahadikusumah, 1985, Metabolisme Energi, Karbohidrat dan Lipid, Bandung, ITB
- Harjasasmita, 1996, Ikhtisar Biokimia Dasar B, Jakarta, FKUI
- Toha, 2001, Biokimia, Metabolisme Biomolekul, Bandung, Alfabeta
- Poedjiadi, Supriyanti, 2007, Dasr-Dasar Biokimia, Bandung, UI Press
- dr-suparyanto.blogspot.com
Label:
keperawatan,
kesehatan,
kimia farmasi,
Pengetahuan,
penyakit,
sosial,
umum
INTERAKSI OBAT

Pendahuluan
Interaksi obat adalah perubahan efek suatu obat akibat pemakaian obat lain (interaksi obat-obat) atau oleh makanan, obat tradisional dan senyawa kimia lain. Interaksi obat yang signifikan dapat terjadi jika dua atau lebih obat digunakan bersama-sama.
Interaksi obat dan efek samping obat perlu mendapat perhatian. Sebuah studi di Amerika menunjukkan bahwa setiap tahun hampir 100.000 orang harus masuk rumah sakit atau harus tinggal di rumah sakit lebih lama dari pada seharusnya, bahkan hingga terjadi kasus kematian karena interaksi dan/atau efek samping obat. Pasien yang dirawat di rumah sakit sering mendapat terapi dengan polifarmasi (6-10 macam obat) karena sebagai subjek untuk lebih dari satu dokter, sehingga sangat mungkin terjadi interaksi obat terutama yang dipengaruhi tingkat keparahan penyakit atau usia.
Interaksi obat secara klinis penting bila berakibat peningkatan toksisitas dan/atau pengurangan efektivitas obat. Jadi perlu diperhatikan terutama bila menyangkut obat dengan batas keamanan yang sempit (indeks terapi yang rendah), misalnya glikosida jantung, antikoagulan dan obat-obat sitostatik. Selain itu juga perlu diperhatikan obat-obat yang biasa digunakan bersama-sama.
Kejadian interaksi obat dalam klinis sukar diperkirakan karena :
a. dokumentasinya masih sangat kurang
b. seringkali lolos dari pengamatan, karena kurangnya pengetahuan akan mekanisme dan kemungkinan terjadi interaksi obat. Hal ini mengakibatkan interaksi obat berupa peningkatan toksisitas dianggap sebagai reaksi idiosinkrasi terhadap salah satu obat, sedangkan interaksi berupa penurunakn efektivitas dianggap diakibatkan bertambah parahnya penyakit pasien
c. kejadian atau keparahan interaksi obat dipengaruhi oleh variasi individual, di mana populasi tertentu lebih peka misalnya pasien geriatric atau berpenyakit parah, dan bisa juga karena perbedaan kapasitas metabolisme antar individu. Selain itu faktor penyakit tertentu terutama gagal ginjal atau penyakit hati yang parah dan faktor-faktor lain (dosis besar, obat ditelan bersama-sama, pemberian kronik).
Mekanisme Interaksi Obat
Interaksi diklasifikasikan berdasarkan keterlibatan dalam proses farmakokinetik maupun farmakodinamik. Interaksi farmakokinetik ditandai dengan perubahan kadar plasma obat, area di bawah kurva (AUC), onset aksi, waktu paro dsb. Interaksi farmakokinetik diakibatkan oleh perubahan laju atau tingkat absorpsi, distribusi, metabolisme dan ekskresi. Interaksi farmakodinamik biasanya dihubungkan dengan kemampuan suatu obat untuk mengubah efek obat lain tanpa mengubah sifat-sifat farmakokinetiknya. Interaksi farmakodinamik meliputi aditif (efek obat A =1, efek obat B = 1, efek kombinasi keduanya = 2), potensiasi (efek A = 0, efek B = 1, efek kombinasi A+B = 2), sinergisme (efek A = 1, efek B = 1, efek kombinasi A+B = 3) dan antagonisme (efek A = 1, efek B = 1, efek kombinasi A+B = 0). Mekanisme yang terlibat dalam interaksi farmakodinamik adalah perubahan efek pada jaringan atau reseptor.
Interaksi farmakokinetik
1. Absorpsi
Obat-obat yang digunakan secara oral bisaanya diserap dari saluran cerna ke dalam sistem sirkulasi. Ada banyak kemungkinan terjadi interaksi selama obat melewati saluran cerna. Absorpsi obat dapat terjadi melalui transport pasif maupun aktif, di mana sebagian besar obat diabsorpsi secara pasif. Proses ini melibatkan difusi obat dari daerah dengan kadar tinggi ke daerah dengan kadar obat yang lebih rendah. Pada transport aktif terjadi perpindahan obat melawan gradien konsentrasi (contohnya ion-ion dan molekul yang larut air) dan proses ini membutuhkan energi. Absorpsi obat secara transport aktif lebih cepat dari pada secara tansport pasif. Obat dalam bentuk tak-terion larut lemak dan mudah berdifusi melewati membran sel, sedangkan obat dalam bentuk terion tidak larut lemak dan tidak dapat berdifusi. Di bawah kondisi fisiologi normal absorpsinya agak tertunda tetapi tingkat absorpsinya biasanya sempurna.
Bila kecepatan absorpsi berubah, interaksi obat secara signifikan akan lebih mudah terjadi, terutama obat dengan waktu paro yang pendek atau bila dibutuhkan kadar puncak plasma yang cepat untuk mendapatkan efek. Mekanisme interaksi akibat gangguan absorpsi antara lain :
a. Interaksi langsung
Interaksi secara fisik/kimiawi antar obat dalam lumen saluran cerna sebelum absorpsi dapat mengganggu proses absorpsi. Interaksi ini dapat dihindarkan atau sangat dikuangi bila obat yang berinteraksi diberikan dalam jangka waktu minimal 2 jam.
b. perubahan pH saluran cerna
Cairan saluran cerna yang alkalis, misalnya akibat adanya antasid, akan meningkatkan kelarutan obat yang bersifat asam yang sukar larut dalam saluran cerna, misalnya aspirin. Dengan demikian dipercepatnya disolusi aspirin oleh basa akan mempercepat absorpsinya. Akan tetapi, suasana alkalis di saluran cerna akan mengurangi kelarutan beberapa obat yang bersifat basa (misalnya tetrasiklin) dalam cairan saluran cerna, sehingga mengurangi absorpsinya. Berkurangnya keasaman lambung oleh antasida akan mengurangi pengrusakan obat yang tidak tahan asam sehingga meningkatkan bioavailabilitasnya.
Ketokonazol yang diminum per oral membutuhkan medium asam untuk melarutkan sejumlah yang dibutuhkan sehingga tidak memungkinkan diberikan bersama antasida, obat antikolinergik, penghambatan H2, atau inhibitor pompa proton (misalnya omeprazol). Jika memang dibutuhkan, sebaiknya abat-obat ini diberikan sedikitnya 2 jam setelah pemberian ketokonazol.
c. pembentukan senyawa kompleks tak larut atau khelat, dan adsorsi
Interaksi antara antibiotik golongan fluorokinolon (siprofloksasin, enoksasin, levofloksasin, lomefloksasin, norfloksasin, ofloksasin dan sparfloksasin) dan ion-ion divalent dan trivalent (misalnya ion Ca2+ , Mg2+ dan Al3+ dari antasida dan obat lain) dapat menyebabkan penurunan yang signifikan dari absorpsi saluran cerna, bioavailabilitas dan efek terapetik, karena terbentuknya senyawa kompleks. Interaksi ini juga sangat menurunkan aktivitas antibiotik fluorokuinolon. Efek interaksi ini dapat secara signifikan dikurangi dengan memberikan antasida beberapa jam sebelum atau setelah pemberian fluorokuinolon. Jika antasida benar-benar dibutuhkan, penyesuaian terapi, misalnya penggantian dengan obat-pbat antagonis reseptor H2 atau inhibitor pompa proton dapat dilakukan.
Beberapa obat antidiare (yang mengandung atapulgit) menjerap obat-obat lain, sehingga menurunkan absorpsi. Walaupun belum ada riset ilmiah, sebaiknya interval pemakaian obat ini dengan obat lain selama mungkin.
d. obat menjadi terikat pada sekuestran asam empedu (BAS : bile acid sequestrant)
Kolestiramin dan kolestipol dapat berikatan dengan asam empedu dan mencegah reabsorpsinya, akibatnya dapat terjadi ikatan dengan obat-obat lain terutama yang bersifat asam (misalnya warfarin). Sebaiknya interval pemakaian kolestiramin atau kolestipol dengan obat lain selama mungkin (minimal 4 jam).
e. perubahan fungsi saluran cerna (percepatan atau lambatnya pengosongan lambung, perubahan vaksularitas atau permeabilitas mukosa saluran cerna, atau kerusakan mukosa dinding usus).
.1. Distribusi
Setelah obat diabsorpsi ke dalam sistem sirkulasi, obat di bawa ke tempat kerja di mana obat akan bereaksi dengan berbagai jaringan tubuh dan atau reseptor. Selama berada di aliran darah, obat dapat terikat pada berbagai komponen darah terutama protein albumin. Obat-obat larut lemak mempunyai afinitas yang tinggi pada jaringan adiposa, sehingga obat-obat dapat tersimpan di jaringan adiposa ini. Rendahnya aliran darah ke jaringan lemak mengakibatkan jaringan ini menjadi depot untuk obat-obat larut lemak. Hal ini memperpanjang efek obat. Obat-obat yang sangat larut lemak misalnya golongan fenotiazin, benzodiazepin dan barbiturat.
Sejumlah obat yang bersifat asam mempunyai afinitas terhadap protein darah terutama albumin. Obat-obat yang bersifat basa mempunyai afinitas untuk berikatan dengan asam-α-glikoprotein. Ikatan protein plasma (PPB : plasma protein binding) dinyatakan sebagai persen yang menunjukkan persen obat yang terikat. Obat yang terikat albumin secara farmakologi tidak aktif, sedangkan obat yang tidak terikat, biasa disebut fraksi bebas, aktif secara farmakologi. Bila dua atau lebih obat yang sangat terikat protein digunakan bersama-sasam, terjadi kompetisi pengikatan pada tempat yang sama, yang mengakibatkan terjadi penggeseran salah satu obat dari ikatan dengan protein, dan akhirnya terjadi peninggatan kadar obat bebas dalam darah. Bila satu obat tergeser dari ikatannya dengan protein oleh obat lain, akan terjadi peningkatan kadar obat bebas yang terdistribusi melewati berbagai jaringan. Pada pasien dengan hipoalbuminemia kadar obat bebas atau bentuk aktif akan lebih tinggi.
Asam valproat dilaporkan menggeser fenitoin dari ikatannya dengan protein dan juga menghambat metabolisme fenitoin. Jika pasien mengkonsumsi kedua obat ini, kadar fenitoin tak terikat akan meningkat secara signifikan, menyebabkan efek samping yang lebih besar. Sebaliknya, fenitoin dapat menurunkan kadar plasma asam valproat. Terapi kombinasi kedua obat ini harus dimonitor dengan ketat serta dilakukan penyesuaian dosis.
Obat-obat yang cenderung berinteraksi pada proses distribusi adalah obat-obat yang :
persen terikat protein tinggi ( lebih dari 90%)
terikat pada jaringan
mempunyai volume distribusi yang kecil
mempunyai rasio eksresi hepatic yang rendah
mempunyai rentang terapetik yang sempit
mempunyai onset aksi yang cepat
digunakan secara intravena.
Obat-obat yang mempunyai kemampuan tinggi untuk menggeser obat lain dari ikatan dengan protein adalah asam salisilat, fenilbutazon, sulfonamid dan anti-inflamasi nonsteroid.
.2. Metabolisme
Untuk menghasilkan efek sistemik dalam tubuh, obat harus mencapai reseptor, berarti obat harus dapat melewati membran plasma. Untuk itu obat harus larut lemak. Metabolisme dapat mengubah senyawa aktif yang larut lemak menjadi senyawa larut air yang tidak aktif, yang nantinya akan diekskresi terutama melalui ginjal. Obat dapat melewati dua fase metabolisme, yaitu metabolisme fase I dan II. Pada metabolisme fase I, terjadi oksidasi, demetilasi, hidrolisa, dsb. oleh enzim mikrosomal hati yang berada di endothelium, menghasilkan metabolit obat yang lebih larut dalam air. Pada metabolisme fase II, obat bereaksi dengan molekul yang larut air (misalnya asam glukuronat, sulfat, dsb) menjadi metabolit yang tidak atau kurang aktif, yang larut dalam air. Suatu senyawa dapat melewati satu atau kedua fasemetabolisme di atas hingga tercapai bentuk yang larut dalam air. Sebagian besar interaksi obat yang signifikan secara klinis terjadi akibat metabolisme fase I dari pada fase II.
a. Peningkatan metabolisme
Beberapa obat bisa meningkatkan aktivitas enzim hepatik yang terlibat dalam metabolisme obat-obat lain. Misalnya fenobarbital meningkatkan metabolisme warfarin sehingga menurunkan aktivitas antikoagulannya. Pada kasus ini dosis warfarin harus ditingkatkan, tapi setelah pemakaian fenobarbital dihentikan dosis warfarin harus diturunkan untuk menghindari potensi toksisitas. Sebagai alternative dapat digunakan sedative selain barbiturate, misalnya golongan benzodiazepine. Fenobarbital juga meningkatkan metabolisme obat-obat lain seperti hormone steroid.
Barbiturat lain dan obat-obat seperti karbamazepin, fenitoin dan rifampisin juga menyebabkan induksi enzim.
Piridoksin mempercepat dekarboksilasi levodopa menjadi metabolit aktifnya, dopamine, dalam jaringan perifer. Tidak seperti levodopa, dopamine tidak dapat melintasi sawar darah otak untuk memberikan efek antiparkinson. Pemberian karbidopa (suatu penghambat dekarboksilasi) bersama dengan levodopa, dapat mencegah gangguan aktivitas levodopa oleh piridoksin,
b. Penghambatan metabolisme
Suatu obat dapat juga menghambat metabolisme obat lain, dengan dampak memperpanjang atau meningkatkan aksi obat yang dipengaruhi. Sebagai contoh, alopurinol mengurangi produksi asam urat melalui penghambatan enzim ksantin oksidase, yang memetabolisme beberapa obat yang potensial toksis seperti merkaptopurin dan azatioprin. Penghambatan ksantin oksidase dapat secara bermakna meningkatkan efek obat-obat ini. Sehingga jika dipakai bersama alopurinol, dosis merkaptopurin atau azatioprin harus dikurangi hingga 1/3 atau ¼ dosis biasanya.
Simetidin menghambat jalur metabolisme oksidatif dan dapat meningkatkan aksi obat-obat yang dimetabolisme melalui jalur ini (contohnya karbamazepin, fenitoin, teofilin, warfarin dan sebagian besar benzodiazepine). Simetidin tidak mempengaruhi aksi benzodiazein lorazepam, oksazepam dan temazepam, yang mengalami konjugasi glukuronida. Ranitidin mempunyai efek terhadap enzim oksidatif lebih rendah dari pada simetidin, sedangkan famotidin dan nizatidin tidak mempengaruhi jalur metabolisme oksidatif.
Eritromisin dilaporkan menghambat metabolisme hepatik beberapa obat seperti karbamazepin dan teofilin sehingga meningkatkan efeknya. Obat golongan fluorokuinolon seperti siprofloksasin juga meningkatkan aktivitas teofilin, diduga melalui mekanisme yang sama.
3. Ekskresi
Kecuali obat-obat anestetik inhalasi, sebagian besar obat diekskresi lewat empedu atau urin. Darah yang memasuki ginjal sepanjang arteri renal, mula-mula dikirim ke glomeruli tubulus, dimana molekul-molekul kecil yang cukup melewati membran glomerular (air, garam dan beberapa obat tertentu) disaring ke tubulus. Molekul-molekul yang besar seperti protein plasma dan sel darah ditahan. Aliran darah kemudian melewati bagian lain dari tubulus ginjal dimana transport aktif yang dapat memindahkan obat dan metabolitnya dari darah ke filtrat tubulus. Sel tubulus kemudian melakukan transport aktif maupun pasif (melalui difusi) untuk mereabsorpsi obat. Interaksi bis terjadi karena perubahan ekskresi aktif tubuli ginjal, perubahan pH dan perubahan aliran darah ginjal.
a. Perubahan ekskresi aktif tubuli ginjal
b. perubahan pH urin
c. Perubahan aliran darah ginjal
Sumber :
Harkness Richard, diterjemahkan oleh Goeswin Agoes dan Mathilda B.Widianto. Interaksi obat. Bandung: Penerbit ITB, 1989
BUFFER DAN KAPASITAS BUFFER

Larutan penyangga atau larutan buffer atau dapar merupakan suatu larutan yang dapat mempertahankan nilai pH tertentu. Adapun sifat yang paling menonjol dari larutan penyangga ini seperti pH larutan penyangga hanya berubah sedikit pada penambahan sedikit asam kuat.
Disamping itu larutan penyangga merupakan larutan yang dibentuk oleh reaksi suatu asam lemah dengan basa konjugatnya ataupun oleh basa lemah dengan asam konjugatnya. Reaksi ini disebut sebagai reaksi asam-basa konjugasi. Disamping itu mempunyai sifat berbeda dengan komponen-komponen pembentuknya.
Secara umum,larutan penyangga dibuat dengan campuran antara asam lemah dan asam konjugasinya, campuran ini menghasilkan larutan bersifat asam. Kemudian campuran antara basa lemah dan asam konjugasinya,campuran ini menghasilkan larutan bersifat basa.
Komponen larutan penyangga terbagi menjadi:
1. Larutan penyangga yang bersifat asam
Larutan ini mempertahankan pH pada daerah asam (pH < 7). Untuk mendapatkan larutan ini dapat dibuat dari asam lemah dan garamnya yang merupakan basa konjugasi dari asamnya. Adapun cara lainnya yaitu mencampurkan suatu asam lemah dengan suatu basa kuat dimana asam lemahnya dicampurkan dalam jumlah berlebih. Campuran akan menghasilkan garam yang mengandung basa konjugasi dari asam lemah yang bersangkutan. Pada umumnya basa kuat yang digunakan seperti natrium, kalium, barium, kalsium, dan lain-lain.
2. Larutan penyangga yang bersifat basa Larutan ini mempertahankan pH pada daerah basa (pH > 7). Untuk mendapatkan larutan ini dapat dibuat dari basa lemah dan garam, yang garamnya berasal dari asam kuat. Adapun cara lainnya yaitu dengan mencampurkan suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan berlebih.
Adanya larutan penyangga ini dapat kita lihat dalam kehidupan sehari-hari seperti pada obat-obatan, fotografi, industri kulit dan zat warna. Selain aplikasi tersebut, terdapat fungsi penerapan konsep larutan penyangga ini dalam tubuh manusia seperti pada cairan tubuh.
Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga utama dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga pH darah yang hampir konstan yaitu sekitar 7,4.
Selain itu penerapan larutan penyangga ini dapat kita temui dalam kehidupan sehari-hari seperti pada obat tetes mata.
CARA MENGHITUNG LARUTAN BUFFER
1. Untuk larutan buffer yang terdiri atas campuran asam lemah dengan garamnya (larutannya akan selalu mempunyai pH < 7) digunakan rumus: [H+] = Ka. Ca/Cg pH = pKa + log Ca/Cg dimana: Ca = konsentrasi asam lemah Cg = konsentrasi garamnya Ka = tetapan ionisasi asam lemah 2. Untuk larutan buffer yang terdiri atas campuran basa lemah dengan garamnya (larutannya akan selalu mempunyai pH > 7), digunakan rumus:
[OH-] = Kb . Cb/Cg
pOH = pKb + log Cg/Cb
dimana:
Cb = konsentrasi base lemah
Cg = konsentrasi garamnya
Kb = tetapan ionisasi basa lemah
Prinsip kerja larutan buffer sebenarnya penambahan sedikit asam, basa, atau pengenceran pada larutan penyangga menimbulkan sedikit perubahan pH (tetapi besar perubahan pH sangatlah kecil) sehingga pH larutan dianggap tidak bertambah atau pH tetap pada kisarannya. Namun, jika asam atau basa ditambahkan ke larutan bukan penyangga maka perubahan pH larutan akan sangat mencolok.Prinsip kerja dari larutan penyangga yang dapat mempertahankan harga pH pada kisarannya adalah sebagai berikut.
a. Larutan Penyangga Asam HA/A -
HA (aq) --> A - (aq) + H + (aq)
- Jika ditambah sedikit asam kuat (H + )
A - (aq) + H + (aq) → HA (aq)
sehingga pada kesetimbangan yang baru tidak terdapat perubahan konsentrasi H + yang berarti, besarnya pH dapat dipertahankan pada kisarannya.
- Jika ditambah sedikit basa kuat (OH - )
OH - (aq) + H + (aq) → H 2 O (l)
HA (aq) → A - (aq) + H + (aq)
sehingga, pada kesetimbangan yang baru tidak terdapat perubahan konsentrasi H + yang nyata; pH larutan dapat dipertahankan pada kisarannya. Asam lemah dapat menetralisir penambahan sedikit basa OH - .
HA (aq) + OH - (aq) → A - (aq) + H 2 O (l)
- Jika larutan penyangga diencerkan
b. Larutan Penyangga Basa B/BH +
B (aq) + H 2 O (l) ----> BH + (aq) + OH - (aq)
- Penambahan sedikit asam kuat (H + )
H + (aq) + OH - (aq) → H 2 O (l)
B (aq) + H 2 O (l) → BH + (aq) + OH - (aq)
Pada kesetimbangan yang baru tidak terdapat perubahan pH yang nyata, besarnya pH dapat dipertahankan. Basa lemah dapat menetralkan penambahan sedikit asam (H + ).
B (aq) + H + (aq) → BH + (aq)
- Penambahan sedikit basa kuat (OH - )
BH + (aq) + OH - (aq) → B (aq) + H 2 O (l)
- Penambahan air (pengenceran)
sumber :wiro-pharmacy.blogspot.com
Label:
biologi,
kimia farmasi,
mikrobiologi,
Pengetahuan,
sosial,
umum,
zat kimia berbahaya
TITRASI PERMANGANOMETRI
Permanganometri adalah penetapan kadar zat berdasarkan hasil oksidasi
dengan KMnO4. Metode permanganometri didasarkan pada reaksi oksidasi
ion permanganat. Oksidasi ini dapat berlangsung dalam suasana asam,
netral dan alkalis.
MnO4- + 8H+ + 5e → Mn 2+ + 4H2O
Kalium permanganat dapat bertindak sebagai indikator, dan umumnya titrasi dilakukan dalam suasan asam karena karena akan lebih mudah mengamati titik akhir titrasinya. Namun ada beberapa senyawa yang lebih mudah dioksidasi dalam suasana netral atau alkalis contohnya hidrasin, sulfit, sulfida, sulfida dan tiosulfat .
Reaksi dalam suasana netral yaitu
MnO4 + 4H+ + 3e → MnO4 +2H2O
Kenaikan konsentrasi ion hidrogen akan menggeser reaksi kekanan
Reaksi dalam suasana alkalis :
MnO4- + 3e → MnO42-
MnO42- + 2H2 O + 2e → MnO2 + 4OH-
MnO4- + 2H2 O + 3e → MnO2 +4OH-
Reaksi ini lambat dalam larutan asam, tetapi sangat cepat dalam larutan netral. Karena alasan ini larutan kalium permanganat jarang dibuat dengan melarutkan jumah-jumlah yang ditimbang dari zat padatnya yang sangat dimurnikan misalnya proanalisis dalam air, lebih lazim adalah untuk memanaskan suatu larutan yang baru saja dibuat sampai mendidih dan mendiamkannya diatas penangas uap selama satu /dua jam lalu menyaring larutan itu dalam suatu penyaring yang tak mereduksi seperti wol kaca yang telah dimurnikan atau melalui krus saring dari kaca maser.
Permanganat bereaksi secara cepat dengan banyak agen pereduksi berdasarkan pereaksi ini, namun beberapa pereaksi membutuhkan pemanasan atau penggunaan sebuah katalis untuk mempercepat reaksi. Kalau bukan karena fakta bahwa banyak reaksi permanganat berjalan lambat, akan lebih banyak kesulitan lagi yang akan ditemukan dalam penggunaan reagen ini sebagai contoh, permanganat adalah agen unsur pengoksida, yang cukup kuat untuk mengoksida Mn(II) menjadi MnO2 sesuai dengan persamaan
3Mn2+ + 2MnO4- + 2H2O → 5MnO2 + 4H+
Kelebihan sedikit dari permanganat yang hadir pada titik akhir dari titrasi cukup untuk mengakibatkan terjadinya pengendapan sejumlah MnO2 .
Tindakan pencegahan khusus harus dilakukan dalam pembuatan larutan permanganat. Mangan dioksidasi mengkatalisis dekomposisi larutan permanganate. Jejak-jejak dari MNO2 yang semula ada dalam permanganat. Atau terbentuk akibat reaksi antara permanganat dengan jejak-jejak dari agen-agen produksi didalam air, mengarah pada dekomposisi. Tindakan ini biasanya berupa larutan kristal-kristalnya, pemanasan untuk menghancurkan substansi yang dapat direduksi dan penyaringan melalui asbestos atau gelas yang disinter untuk menghilangkan MNO2. Larutan tersebut kemudian distandarisasi dan jika disimpan dalam gelap dan tidak diasamkan konsentrasinya tidak akan banyak berubah selama beberapa bulan.
Penentuan besi dalam biji-biji besi adalah salah satu aplikasi terpenting dalam titrasi-titrasi permanganat. Asam terbaik untuk melarutkan biji besi adalah asam klorida dan timah (II) klorida sering ditambahkan untuk membantu proses kelarutan.
Sebelum dititrasi dengan permanganat setiap besi (III) harus di reduksi menjadi besi (II). Reduksi ini dapat dilakukan dengan reduktor jones atau dengan timah (II) klorida. Reduktor jones lebih disarankan jika asam yang tersedia adalah sulfat mengingat tidak ada ion klorida yang masuk .
Jika larutannya mengandung asam klorida seperti yang sering terjadi reduksi dengan timah (II) klorida akan lebih memudahkan. Klorida ditambahkan kedalam larutan panas dari sampelnya dan perkembangan reduksi diikuti dengan memperhatikan hilangnya warna kuning dari ion besi.
ANALISIS BAHAN
1.KMnO4 ( FI III ,330 )
Nama resmi = KALII PERMANGANAS
Nama lain = Kalium permanganate
RM = KMnO4
BM = 158,03
Pemerian = Hablur mengkilap, ungu tua /hampir hitam, tidak berbau, rasa manis /sepat.
Kelarutan = Larut dalam 16 bagian air, mudah larut dalam air mendidih .
Kegunaan = Sebagai sampel
Penyimpanan = Dalam wadah tertutup rapat
2. Aquadest ( FI III,96 )
Nama resmi = AQUADESTILLATA
Nama lain = Air suling
RM = H2O
BM = 18,02
Pemerian = Cairan jernih, tidak berwarna, tidak berasa, tidak berbau.
Kelarutan = Larut dalam etanol dan gliserol
Kegunaan = Sebagai pelarut
Penyimpanan = Dalam wadah tertutup rapat
3. Asam oksalat (FI III,651)
Nama lain = Asam oksalat
RM = (CO2H)2.2H2O
Pemerian = Hablur ,tidak berwarna .
Kelarutan = Larut dalam air dan etanol
Kegunaan = Sebagai zat tambahan
Penyimpanan = Dalam wadah tertutup rapat
4. Besi (II) sulfat (FI III,254)
Nama resmi = FERROSI SULFAS
Nama lain = Besi (II) sulfat
RM = FeSO4
BM = 151,90
Pemerian = Serbuk, putih keabuan ,rasa logam ,sepat
Kelarutan = Perlahan-lahan larut hamper sempurna dalam air bebas karbondioksida pekat.
Kegunaan = Sebagai sampel
Penyimpanan = Dalam wadah tertutup baik
5. Asam sulfat (FI III,58)
Nama resmi = ACIDUM SULFURICUM
Nama lain = Asam sulfat
RM = H2 SO4
BM = 98,07
Pemerian = Cairan kental, seperti minyak, korosif tidak berwarna, jika ditambahkan kedalam air menimbulkan panas.
Kegunaan = Sebagai larutan titer.
Penyimpanan = Dalam wadah tertutup rapat.
6. Natrium nitrit (FI III,714)
Nama resmi = -
Nama lain = NATRIUM NITRIT
RM = NaNO2
Pemerian = Tidak berwarna /putih /kuning : merapuh
Kelarutan = larut dalam 1,5 bagian air, agak sukar larut dalam etanol (95 %)P.
Kegunaan = Sebagai penitrasi
Penyimpanan = Dalam wadah tertutup baik.
SUMBER:
Anonim.1979. Farmakope Indonesia III. Jakarta: DEPKES RI.
BASSET. J dan DENNEY R. C .1994. Vogel. Kimia Analisis Kuantitatif Anorganik. Penerbit buku kedokteran : Jakarta. Hal : 406-410.
DAY. J.Y dan UNDERWOOD A. L. 2002. Analisis kimia kuantitatif .
Erlangga : Jakarta . hal: 290-293.
wiro-pharmacy.blogspot.com
MnO4- + 8H+ + 5e → Mn 2+ + 4H2O
Kalium permanganat dapat bertindak sebagai indikator, dan umumnya titrasi dilakukan dalam suasan asam karena karena akan lebih mudah mengamati titik akhir titrasinya. Namun ada beberapa senyawa yang lebih mudah dioksidasi dalam suasana netral atau alkalis contohnya hidrasin, sulfit, sulfida, sulfida dan tiosulfat .
Reaksi dalam suasana netral yaitu
MnO4 + 4H+ + 3e → MnO4 +2H2O
Kenaikan konsentrasi ion hidrogen akan menggeser reaksi kekanan
Reaksi dalam suasana alkalis :
MnO4- + 3e → MnO42-
MnO42- + 2H2 O + 2e → MnO2 + 4OH-
MnO4- + 2H2 O + 3e → MnO2 +4OH-
Reaksi ini lambat dalam larutan asam, tetapi sangat cepat dalam larutan netral. Karena alasan ini larutan kalium permanganat jarang dibuat dengan melarutkan jumah-jumlah yang ditimbang dari zat padatnya yang sangat dimurnikan misalnya proanalisis dalam air, lebih lazim adalah untuk memanaskan suatu larutan yang baru saja dibuat sampai mendidih dan mendiamkannya diatas penangas uap selama satu /dua jam lalu menyaring larutan itu dalam suatu penyaring yang tak mereduksi seperti wol kaca yang telah dimurnikan atau melalui krus saring dari kaca maser.
Permanganat bereaksi secara cepat dengan banyak agen pereduksi berdasarkan pereaksi ini, namun beberapa pereaksi membutuhkan pemanasan atau penggunaan sebuah katalis untuk mempercepat reaksi. Kalau bukan karena fakta bahwa banyak reaksi permanganat berjalan lambat, akan lebih banyak kesulitan lagi yang akan ditemukan dalam penggunaan reagen ini sebagai contoh, permanganat adalah agen unsur pengoksida, yang cukup kuat untuk mengoksida Mn(II) menjadi MnO2 sesuai dengan persamaan
3Mn2+ + 2MnO4- + 2H2O → 5MnO2 + 4H+
Kelebihan sedikit dari permanganat yang hadir pada titik akhir dari titrasi cukup untuk mengakibatkan terjadinya pengendapan sejumlah MnO2 .
Tindakan pencegahan khusus harus dilakukan dalam pembuatan larutan permanganat. Mangan dioksidasi mengkatalisis dekomposisi larutan permanganate. Jejak-jejak dari MNO2 yang semula ada dalam permanganat. Atau terbentuk akibat reaksi antara permanganat dengan jejak-jejak dari agen-agen produksi didalam air, mengarah pada dekomposisi. Tindakan ini biasanya berupa larutan kristal-kristalnya, pemanasan untuk menghancurkan substansi yang dapat direduksi dan penyaringan melalui asbestos atau gelas yang disinter untuk menghilangkan MNO2. Larutan tersebut kemudian distandarisasi dan jika disimpan dalam gelap dan tidak diasamkan konsentrasinya tidak akan banyak berubah selama beberapa bulan.
Penentuan besi dalam biji-biji besi adalah salah satu aplikasi terpenting dalam titrasi-titrasi permanganat. Asam terbaik untuk melarutkan biji besi adalah asam klorida dan timah (II) klorida sering ditambahkan untuk membantu proses kelarutan.
Sebelum dititrasi dengan permanganat setiap besi (III) harus di reduksi menjadi besi (II). Reduksi ini dapat dilakukan dengan reduktor jones atau dengan timah (II) klorida. Reduktor jones lebih disarankan jika asam yang tersedia adalah sulfat mengingat tidak ada ion klorida yang masuk .
Jika larutannya mengandung asam klorida seperti yang sering terjadi reduksi dengan timah (II) klorida akan lebih memudahkan. Klorida ditambahkan kedalam larutan panas dari sampelnya dan perkembangan reduksi diikuti dengan memperhatikan hilangnya warna kuning dari ion besi.
ANALISIS BAHAN
1.KMnO4 ( FI III ,330 )
Nama resmi = KALII PERMANGANAS
Nama lain = Kalium permanganate
RM = KMnO4
BM = 158,03
Pemerian = Hablur mengkilap, ungu tua /hampir hitam, tidak berbau, rasa manis /sepat.
Kelarutan = Larut dalam 16 bagian air, mudah larut dalam air mendidih .
Kegunaan = Sebagai sampel
Penyimpanan = Dalam wadah tertutup rapat
2. Aquadest ( FI III,96 )
Nama resmi = AQUADESTILLATA
Nama lain = Air suling
RM = H2O
BM = 18,02
Pemerian = Cairan jernih, tidak berwarna, tidak berasa, tidak berbau.
Kelarutan = Larut dalam etanol dan gliserol
Kegunaan = Sebagai pelarut
Penyimpanan = Dalam wadah tertutup rapat
3. Asam oksalat (FI III,651)
Nama lain = Asam oksalat
RM = (CO2H)2.2H2O
Pemerian = Hablur ,tidak berwarna .
Kelarutan = Larut dalam air dan etanol
Kegunaan = Sebagai zat tambahan
Penyimpanan = Dalam wadah tertutup rapat
4. Besi (II) sulfat (FI III,254)
Nama resmi = FERROSI SULFAS
Nama lain = Besi (II) sulfat
RM = FeSO4
BM = 151,90
Pemerian = Serbuk, putih keabuan ,rasa logam ,sepat
Kelarutan = Perlahan-lahan larut hamper sempurna dalam air bebas karbondioksida pekat.
Kegunaan = Sebagai sampel
Penyimpanan = Dalam wadah tertutup baik
5. Asam sulfat (FI III,58)
Nama resmi = ACIDUM SULFURICUM
Nama lain = Asam sulfat
RM = H2 SO4
BM = 98,07
Pemerian = Cairan kental, seperti minyak, korosif tidak berwarna, jika ditambahkan kedalam air menimbulkan panas.
Kegunaan = Sebagai larutan titer.
Penyimpanan = Dalam wadah tertutup rapat.
6. Natrium nitrit (FI III,714)
Nama resmi = -
Nama lain = NATRIUM NITRIT
RM = NaNO2
Pemerian = Tidak berwarna /putih /kuning : merapuh
Kelarutan = larut dalam 1,5 bagian air, agak sukar larut dalam etanol (95 %)P.
Kegunaan = Sebagai penitrasi
Penyimpanan = Dalam wadah tertutup baik.
SUMBER:
Anonim.1979. Farmakope Indonesia III. Jakarta: DEPKES RI.
BASSET. J dan DENNEY R. C .1994. Vogel. Kimia Analisis Kuantitatif Anorganik. Penerbit buku kedokteran : Jakarta. Hal : 406-410.
DAY. J.Y dan UNDERWOOD A. L. 2002. Analisis kimia kuantitatif .
Erlangga : Jakarta . hal: 290-293.
wiro-pharmacy.blogspot.com
Label:
hukum farmasi,
keperawatan,
kimia farmasi,
obat,
Pengetahuan,
umum,
zat kimia berbahaya
ANALISIS KUALITATIF (KATION ANION)
Analisa kualitatif merupakan suatu proses dalam mendeteksi keberadaan
suatu unsur kimia dalam cuplikan yang tidak diketahui. Analisa
kualitatif merupakan salah satu cara yang paling efektif untuk
mempelajari kimia dan unsur-unsur serta ion-ionnya dalam larutan. Dalam
metode analisis kualitatif kita menggunakan beberapa pereaksi
diantaranya pereaksi golongan dan pereaksi spesifik, kedua pereaksi ini
dilakukan untuk mengetahui jenis anion / kation suatu larutan.
Regensia golongan yang dipakai untuk klasifikasi kation yang paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida, dan amonium karbonat.
Klasifikasi ini didasarkan atas apakah suatu kation bereaksi dengan reagensia-reagensia ini dengan membentuk endapan atau tidak. Sedangkan metode yang digunakan dalam anion tidak sesistematik kation. Namun skema yang digunakan bukanlah skema yang kaku, karena anion termasuk dalam lebih dari satu golongan.
Didalam kation ada beberapa golongan yang memiliki ciri khas tertentu diantaranya :
1. Golongan I : Kation golongan ini membentuk endapan dengan asam klorida encer. Ion golongan ini adalah Pb, Ag, Hg.
2. Golongan II : Kation golongan ini bereaksi dengan asam klorida, tetapi membentuk endapan dengan hidrogen sulfida dalam suasana asam mineral encer. Ion golongan ini adalah Hg, Bi, Cu, cd, As, Sb, Sn.
3. Golongan III : Kation golongan ini tidak bereaksi dengan asam klorida encer, ataupun dengan hidrogen sulfida dalam suasana asam mineral encer. Namun kation ini membentuk endapan dengan ammonium sulfida dalam suasana netral / amoniakal. Kation golongan ini Co, Fe, Al, Cr, Co, Mn, Zn.
4. Golongan IV : Kation golongan ini bereaksi dengan golongan I, II, III. Kation ini membentuk endapan dengan ammonium karbonat dengan adanya ammonium klorida, dalam suasana netral atau sedikit asam. Ion golongan ini adalah Ba, Ca, Sr.
5. Golongan V : Kation-kation yang umum, yang tidak bereaksi dengan regensia-regensia golongan sebelumnya, merupakan golongan kation yang terakhir. Kation golongan ini meliputi : Mg, K, NH4+.
Untuk anion dikelompokkan kedalam beberapa kelas diantaranya :
* Anion sederhana seperti : O2-, F-, atau CN- .
* Anion okso diskret seperti : NO3-, atau SO42-.
* Anion polimer okso seperti silikat, borat, atau fosfat terkondensasi
* Anion kompleks halida seperti TaF6 dan kompleks anion yang berbasis bangat seperti oksalat.
Reaksi dalam anion ini akan lebih dipelajari secara sistematis untuk memudahkan reaksi dari asam-asam organik tertentu dikelompokkan
bersama-sama. Hal ini meliputi asetat, formiat, oksalat, sitrat, salisilat dan benzoat.
Analisis kualitatif menggunakan dua macam uji, yaitu reaksi kering dan reaksi basah. Reaksi kering dapat digunakan pada zat padat dan reaksi basah untuk zat dalam larutan. Kebanyakan reaksi kering yang diuraikan digunakan untuk analisis semimikro dengan hanya modifikasi kecil.
Untuk uji reaksi kering metode yang sering dilakukan adalah
1. Reaksi nyala dengan kawat nikrom : Sedikit zat dilarutkan kedalam HCL P. Diatas kaca arloji kemudian dicelupkan kedalamnya, kawat nikrom yang bermata kecil yang telah bersih kemudian dibakar diatas nyala oksidasi .
2. Reaksi nyala beilstein : Kawat tembaga yang telah bersih dipijarkan diatas nyala oksida sampai nyala hijau hilang. Apabila ada halogen maka nyala yang terjadi berwarna hijau.
3. Reaksi nyala untuk borat : Dengan cawan porselin sedikit zat padat ditambahkan asam sulfat pekat dan beberapa tetes methanol, kemudian dinyalakan ditempat gelap. Apabila ada borat akan timbul warna hijau.
Metode untuk mendeteksi anion memang tidak sesistematik seperti yang digunakan untuk kation. Namun skema klasifikasi pada anion bukanlah skema yang kaku karena beberapa anion termaksud dalam lebih dari satu golongan.
Anion-anion dapat dikelompokkan sebagai berikut:
a. Anion sederhana seperti O2,F- atau CN-.
b. Anion oksodiskret seperti NO3- atau SO42-.
c. Anion polimer okso seperti silikat, borad, atau fospat terkondensasi.
d. Anion kompleks halida, seperti TaF6 dan kompleks anion yang mengandung anion berbasa banyak seperti oksalat
Reaksi-reaksi dalam anion ini akan dipelajari secara sistematis untuk memudahkan reaksi dari asam-asam organik tertentu dikelompokkan
bersama-sama, ini meliputi asetat, format, oksalad, sitrat, salisilad, benzoad, dan saksinat.
sumber :wiro-pharmacy.blogspot.com
Regensia golongan yang dipakai untuk klasifikasi kation yang paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida, dan amonium karbonat.
Klasifikasi ini didasarkan atas apakah suatu kation bereaksi dengan reagensia-reagensia ini dengan membentuk endapan atau tidak. Sedangkan metode yang digunakan dalam anion tidak sesistematik kation. Namun skema yang digunakan bukanlah skema yang kaku, karena anion termasuk dalam lebih dari satu golongan.
Didalam kation ada beberapa golongan yang memiliki ciri khas tertentu diantaranya :
1. Golongan I : Kation golongan ini membentuk endapan dengan asam klorida encer. Ion golongan ini adalah Pb, Ag, Hg.
2. Golongan II : Kation golongan ini bereaksi dengan asam klorida, tetapi membentuk endapan dengan hidrogen sulfida dalam suasana asam mineral encer. Ion golongan ini adalah Hg, Bi, Cu, cd, As, Sb, Sn.
3. Golongan III : Kation golongan ini tidak bereaksi dengan asam klorida encer, ataupun dengan hidrogen sulfida dalam suasana asam mineral encer. Namun kation ini membentuk endapan dengan ammonium sulfida dalam suasana netral / amoniakal. Kation golongan ini Co, Fe, Al, Cr, Co, Mn, Zn.
4. Golongan IV : Kation golongan ini bereaksi dengan golongan I, II, III. Kation ini membentuk endapan dengan ammonium karbonat dengan adanya ammonium klorida, dalam suasana netral atau sedikit asam. Ion golongan ini adalah Ba, Ca, Sr.
5. Golongan V : Kation-kation yang umum, yang tidak bereaksi dengan regensia-regensia golongan sebelumnya, merupakan golongan kation yang terakhir. Kation golongan ini meliputi : Mg, K, NH4+.
Untuk anion dikelompokkan kedalam beberapa kelas diantaranya :
* Anion sederhana seperti : O2-, F-, atau CN- .
* Anion okso diskret seperti : NO3-, atau SO42-.
* Anion polimer okso seperti silikat, borat, atau fosfat terkondensasi
* Anion kompleks halida seperti TaF6 dan kompleks anion yang berbasis bangat seperti oksalat.
Reaksi dalam anion ini akan lebih dipelajari secara sistematis untuk memudahkan reaksi dari asam-asam organik tertentu dikelompokkan
bersama-sama. Hal ini meliputi asetat, formiat, oksalat, sitrat, salisilat dan benzoat.
Analisis kualitatif menggunakan dua macam uji, yaitu reaksi kering dan reaksi basah. Reaksi kering dapat digunakan pada zat padat dan reaksi basah untuk zat dalam larutan. Kebanyakan reaksi kering yang diuraikan digunakan untuk analisis semimikro dengan hanya modifikasi kecil.
Untuk uji reaksi kering metode yang sering dilakukan adalah
1. Reaksi nyala dengan kawat nikrom : Sedikit zat dilarutkan kedalam HCL P. Diatas kaca arloji kemudian dicelupkan kedalamnya, kawat nikrom yang bermata kecil yang telah bersih kemudian dibakar diatas nyala oksidasi .
2. Reaksi nyala beilstein : Kawat tembaga yang telah bersih dipijarkan diatas nyala oksida sampai nyala hijau hilang. Apabila ada halogen maka nyala yang terjadi berwarna hijau.
3. Reaksi nyala untuk borat : Dengan cawan porselin sedikit zat padat ditambahkan asam sulfat pekat dan beberapa tetes methanol, kemudian dinyalakan ditempat gelap. Apabila ada borat akan timbul warna hijau.
Metode untuk mendeteksi anion memang tidak sesistematik seperti yang digunakan untuk kation. Namun skema klasifikasi pada anion bukanlah skema yang kaku karena beberapa anion termaksud dalam lebih dari satu golongan.
Anion-anion dapat dikelompokkan sebagai berikut:
a. Anion sederhana seperti O2,F- atau CN-.
b. Anion oksodiskret seperti NO3- atau SO42-.
c. Anion polimer okso seperti silikat, borad, atau fospat terkondensasi.
d. Anion kompleks halida, seperti TaF6 dan kompleks anion yang mengandung anion berbasa banyak seperti oksalat
Reaksi-reaksi dalam anion ini akan dipelajari secara sistematis untuk memudahkan reaksi dari asam-asam organik tertentu dikelompokkan
bersama-sama, ini meliputi asetat, format, oksalad, sitrat, salisilad, benzoad, dan saksinat.
REAKSI:
Reaksi kation
Golongan I
Ag+
1. Ag+ + HCL → AgCL ↓ putih + H-
2. 2Ag+ + 2 NaOH → 2AgOH + 2Na+ ↓ coklat
3. 2Ag+ + 2NH4 OH → 2 AgOH → NH+
Pb2+
1. Pb2+ + 2NaOH → Pb(OH)2 ↓ putih + 2 Na+
Pb(OH)2 + 2NaOH → Na2Pb(OH)4
2. Pb2+ +2 NH4OH → Pb(OH)2 ↓ putih + 2 NH4+
3. Pb2+ + 2KI → PbI2
Golongan II
Hg2+
1. Hg2+ + 2KI → HgI2 ↓ merah + 2k+
HgI2 +2 KI → K2 HgI2
2. Hg2+ + 2 NaOH → Hg(OH)2 ↓ kuning +2 Na+
3. Hg2+ +2 NH4OH →Hg(OH)2 ↓ putih + 2NH4+
4. Hg2+ + 2CUSO4 → Hg(SO4 )2 + 2 CU2+
CU2+
1. CU2+ + 2KI → CUI2 + 2K+
2. CU2+ + 2 NaOH → CU(OH)2 ↓ biru + 2nA+
3. CU2+ + 2NH4 OH → CU (OH)2 ↓biru + 2NH
Cd2+
1. Cd2+ + KI →
2. Cd2+ + 2NaOH → Cd(OH)2 + 2 Na+
Cd(OH)2 + NaOH → Cd(OH04 ↓ putih
3. Cd2+ + 2 NH4OH → Cd(OH)2 + 2 NH+
Golongan III A
Fe2+
1. Fe2+ + 2NaOH → Fe(OH)2 ↓ hijau kotor + 2Na+
2. Fe2+ + 2NH4OH → Fe(OH)2 ↓ hijau kotor + 2NH4+
3. Fe2+ + 2K4Fe(CN)6 → K4 {Fe(CN)6} ↓ biru + 4k+
4. Fe2+ + KSCN → Fe(SCN)2 + 2K+
Fe3+
1. Fe3+ + 3 NaOH → Fe(OH)3 ↓ kuning + 3Na+
2. Fe3+ + 3 NH4 OH → Fe(OH)3 ↓ Kuning + 3NH4+
3. Fe3+ + 3K4Fe(CN)6}2 → K4{Fe(CN)6}2 ↓ biru +3k+
4. Fe3+ + 3KCNS → Fe(SCN)3 + 3K+
Al3+
1. Al3+ + 3NaOH → Al(OH)3 ↓ putih + 3Na+
2. Al3+ + 3NH4OH → Al(OH)3 ↓ putih + 3NH4+
3. Al3+ + KSCN →
Golongan III B
Zn2-
1. Zn2- + NaOH → Zn(OH)2 ↓ putih + 2Na+
2. Zn2- + Na2CO3 → ZN(CO3)2 ↓ putih + 2Na+
3. Zn2- + K4Fe(CN )6 → Zn4{Fe(CN)6}2 tetap + 8k+
Ni2+
1. Ni2+ + 2NaOH → Ni(OH)2 ↓ hijau + 2Na+
2. Ni2+ + NH4OH → Ni(OH)2 ↓ hijau + 2NH4+
3. Ni2+ + 2Na2CO3 → Ni(CO3)2 ↓ hijau muda + 2Na
4. Ni2+ + K4Fe(CN)6 → Ni4{Fe(CN)6}2 tetap + 8k+
CO2-
1. CO2- + NH4OH → CO(OH)2 ↓ hijau + 2NH4
2. CO2- + 2NaOH → CO9OH)2 ↓ biru + 2Na+
3. CO2- + K4Fe(CN)6 → CO4{Fe(CN)6}2 tetap + 8k+
4. CO2- + 2Na2CO3 → CO(CO3)2 ↓ hijau muda + 2Na
Golongan IV
Ba2-
1. Ba2- + k2 CrO4 → BaCrO4 ↓ kuning
2. Ba2- + Na2CO3 → BaCO3 ↓ putih
Uji nyala
Ba → kuning kehijaun
Ca2+
1. Ca2+ + K2CrO4 → CaCrO4 Lart. Kuning +2K+
2. Ca2+ + Na2 CO3 → CaCO3 + 2Na+
Untuk uji nyala
Ca → merah kekuningan.
Sr2+
1. Sr2+ + K2CrO4 → SrCrO4 Lart. Kuning + 2K
2. Sr2+ + Na2CO3 → SrCO3 + 2Na+
Untuk uji nyala
Sr → merah karmin
Golongan V
Mg2+
1. Mg2+ + 2 NaOH → Mg(OH)2 putih + 2Na+
2. Mg2+ + 2 NH4OH → Mg(OH)2 tetap + 2NH4+
3. Mg2+ + Na3CO(NO2)6 → Mg3{CO(NO2)6} Lart. Merah darah + 3Na
Reaksi Anion
Anion golongan A
Cl-
1. Cl- + AgNO3 → AgCl ↓ putih + NO3-
AgCl + 2NH3 → Ag(NH3)2 + Cl-
2. Cl- + Pb(CH3COO)2 → PbCl2 putih + 2 CH3COO-
3. Cl- + CuSO4 →
I-
1. I- + AgNO3 → AgI putih + NO3-
2. I- + Ba(NO3)2 →
3. 2I- + Pb(CH3COO)2 → PbI2 + 2 CH3COO-
SCN-
1. SCN- + AgNO3 → AgSCN putih + NO3
2. SCN- + Pb(CH3 COO)2 → Pb(SCN)2 putih + 2CH3COO-
3. SCN- + Pb(CH3 COO)2 → Pb(SCN)2 putih + 2CH3COO-
Golongan B
S2-
1. S2- + AgNO3 → Ag2S ↓ hitam + 2NO3
Ag2S + HNO3
2. S2- + FeCl3 → FeS hitam + HNO3
3. S2- + Pb(CH3COO)2 → PbSO4 hitam + 2CH3COO-
Golongan C
CH3 COO-
1. CH3COO- + H2SO4 → CH3 COOH + SO4
2. CH3COO- + Ba(NO3)2
3. CH3COO- + 3FeCl3 + 2H2O→ (CH3COO)6 + 2HCL + 4H2O
→ 3Fe(OH)2
CH3COO- merah + 3CH3COOH +HCL
Golongan D
SO32-
1. SO32- + AgNO3 → Ag2SO3 putih + 2 NO3
Ag2SO3 + 2HNO3 → 2AgNO3 + H2SO4
2. SO32- + Ba(NO3 )2 → BaSO3 putih + 2NO3
BaSO3 + 2HNO3 → Ba(NO3)2 + H2SO3
3. SO32- + Pb(CH3COO)2 → PbSO3 putih + 2CH3 COO-
PbSO3 + 2HNO3 → Pb(NO3) 2 + H2SO3
CO32-
1. CO32- + AgNO3 → Ag2CO3 putih + 2NO3-
Ag2CO3 + 2NO3- → 2AgNO3 + H2CO3
2. CO32- + Mg(SO4)2 → MgCO3 putih + 2SO42-
Golongan E
S2O3
1. S2O32- + FeCl3 → Fe(S2O3 )3 Cl + 2Cl-
2. Pb(CH3COO)2 → PbS2O3 putih + 2CH3COO-
Golongan F
PO43-
1. PO43- + Ba(NO3 )2 → Ba3(PO4 )2 putih + 2NO3-
2. PO43- + FeCl3 → FePO4 putih kuning + 3 Cl-
Golongan G
1. Anion NO32- → ↓ coklat tipis + FeSO4 + H2SO4 P.
2. NO32- + 4H2SO4 + 6FeSO4 → 6Fe + 2NO + 4SO4 + 4H2O
SUMBER :
Shvehla, G. 1995. Vogel Buku Teks Analisis Makro dan Semimikro I. PT. Kalman Media Pustaka: Jakarta.
Haryadi. 1990. Ilmu Kimia Analitik Dasar. PT. Gramedia: Jakarta.sumber :wiro-pharmacy.blogspot.com
TITRASI ASAM BASA (NETRALISASI) :)
Titrasi adalah suatu metode penentuan kadar (konsentrasi) suatu
larutan dengan larutan lain yang telah diketahui konsentrasinya. Titrasi
merupakan suatu metoda untuk menentukan kadar suatu zat dengan
menggunakan zat lain yang sudah dikethaui konsentrasinya. Titrasi
biasanya dibedakan berdasarkan jenis reaksi yang terlibat di dalam
proses titrasi, sebagai contoh bila melibatan reaksi asam basa maka
disebut sebagai titrasi asam basa, titrasi redox untuk titrasi yang
melibatkan reaksi reduksi oksidasi, titrasi kompleksometri untuk titrasi
yang melibatan pembentukan reaksi kompleks dan lain sebagainya.
PRINSIP TITRASI NETRALISASI
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titran. Titrasi asam basa berdasarkan reaksi penetralan. Kadar larutan asam ditentukan dengan menggunakan larutan basa dan sebaliknya.
Titran ditambahkan titer sedikit demi sedikit sampai mencapai keadaan ekuivalen (artinya secara stoikiometri titran dan titer tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekuivalen”.
Pada saat titik ekuivalent ini maka proses titrasi dihentikan, kemudian kita mencatat volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titer maka kita bisa menghitung kadar titrant.
TITIK AKHIR TITRASI
Titik akhir titrasi adalah keadaan dimana reaksi telah berjalan dengan sempurna yang biasanya ditandai dengan pengamatan visual melalui perubahan warna indikator. Indikator yang digunakan pada titrasi asam basa adalah asam lemah atau basa lemah. Asam lemah dan basa lemah ini umumnya senyawa organik yang memiliki ikatan rangkap terkonjugasi yang mengkontribusi perubahan warna pada indikator tersebut. Jumlah indikator yang ditambahkan kedalam larutan yang akan dititrasi harus sesedikit mungkin, sehingga indikator tidak mempengaruhi pH larutan dengan demikian jumlah titran yang diperlukan untuk terjadi perubahan warna juga seminimal mungkin. Umumnya dua atau tiga tetes larutan indikator 0.1%(b/v) diperlukan untuk keperluan titrasi. Dua tetes (0.1 mL) indikator (0.1% dengan berat formula 100) adalah sama dengan 0.01 mL larutan titran dengan konsentrasi 0.1 M.
Berikut tabel indikator asam basa dengan rentang pH dan perubahan warna yang terjadi.

Indikator asam basa akan memiliki warna yang berbeda dalam keadaan tak terionisasi dengan keadaan terionisasi. Sebagai contoh untuk indikator phenolphthalein (pp) seperti diatas dalam keadaan tidak terionisasi (dalam larutan asam) tidak akan berwarna (colorless) dan akan berwarna merah keunguan dalam keadaan terionisasi ( dalam larutan basa).
CARA MENGETAHUI TITIK EKUIVALEN
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa.
1. Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan, kemudian membuat plot antara pH dengan volume titrant untuk memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut adalah “titik ekuivalen”.
2. Memakai indikator asam basa. Indikator ditambahkan pada titran sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan, dan sangat praktis.
Indikator yang dipakai dalam titrasi asam basa adalah indicator yang perbahan warnanya dipengaruhi oleh pH. Penambahan indicator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes.
Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi dipilih sedekat mungkin dengan titik ekuivalen, hal ini dapat dilakukan dengan memilih indikator yang tepat dan sesuai dengan titrasi yang akan dilakukan.
Keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indikator disebut sebagai “titik akhir titrasi”.
sumber :wiro-pharmacy.blogspot.com
PRINSIP TITRASI NETRALISASI
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titran. Titrasi asam basa berdasarkan reaksi penetralan. Kadar larutan asam ditentukan dengan menggunakan larutan basa dan sebaliknya.
Titran ditambahkan titer sedikit demi sedikit sampai mencapai keadaan ekuivalen (artinya secara stoikiometri titran dan titer tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekuivalen”.
Pada saat titik ekuivalent ini maka proses titrasi dihentikan, kemudian kita mencatat volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titer maka kita bisa menghitung kadar titrant.
TITIK AKHIR TITRASI
Titik akhir titrasi adalah keadaan dimana reaksi telah berjalan dengan sempurna yang biasanya ditandai dengan pengamatan visual melalui perubahan warna indikator. Indikator yang digunakan pada titrasi asam basa adalah asam lemah atau basa lemah. Asam lemah dan basa lemah ini umumnya senyawa organik yang memiliki ikatan rangkap terkonjugasi yang mengkontribusi perubahan warna pada indikator tersebut. Jumlah indikator yang ditambahkan kedalam larutan yang akan dititrasi harus sesedikit mungkin, sehingga indikator tidak mempengaruhi pH larutan dengan demikian jumlah titran yang diperlukan untuk terjadi perubahan warna juga seminimal mungkin. Umumnya dua atau tiga tetes larutan indikator 0.1%(b/v) diperlukan untuk keperluan titrasi. Dua tetes (0.1 mL) indikator (0.1% dengan berat formula 100) adalah sama dengan 0.01 mL larutan titran dengan konsentrasi 0.1 M.
Berikut tabel indikator asam basa dengan rentang pH dan perubahan warna yang terjadi.

Indikator asam basa akan memiliki warna yang berbeda dalam keadaan tak terionisasi dengan keadaan terionisasi. Sebagai contoh untuk indikator phenolphthalein (pp) seperti diatas dalam keadaan tidak terionisasi (dalam larutan asam) tidak akan berwarna (colorless) dan akan berwarna merah keunguan dalam keadaan terionisasi ( dalam larutan basa).
CARA MENGETAHUI TITIK EKUIVALEN
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa.
1. Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan, kemudian membuat plot antara pH dengan volume titrant untuk memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut adalah “titik ekuivalen”.
2. Memakai indikator asam basa. Indikator ditambahkan pada titran sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan, dan sangat praktis.
Indikator yang dipakai dalam titrasi asam basa adalah indicator yang perbahan warnanya dipengaruhi oleh pH. Penambahan indicator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes.
Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi dipilih sedekat mungkin dengan titik ekuivalen, hal ini dapat dilakukan dengan memilih indikator yang tepat dan sesuai dengan titrasi yang akan dilakukan.
Keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indikator disebut sebagai “titik akhir titrasi”.
sumber :wiro-pharmacy.blogspot.com
EKSTRAKSI :)
1. Pengertiaan
Secara umum, terdapat empat situasi dalam menentukan tujuan ekstraksi:
1. Senyawa kimia telah diketahui identitasnya untuk diekstraksi dari organisme. Dalam kasus ini, prosedur yang telah dipublikasikan dapat diikuti dan dibuat modifikasi yang sesuai untuk mengembangkan proses atau menyesuaikan dengan kebutuhan pemakai.
2. Bahan diperiksa untuk menemukan kelompok senyawa kimia tertentu, misalnya alkaloid, flavanoid atau saponin, meskipun struktur kimia sebetulnya dari senyawa ini bahkan keberadaannya belum diketahui. Dalam situasi seperti ini, metode umum yang dapat digunakan untuk senyawa kimia yang diminati dapat diperoleh dari pustaka. Hal ini diikuti dengan uji kimia atau kromatografik yang sesuai untuk kelompok senyawa kimia tertentu
3. Organisme (tanaman atau hewan) digunakan dalam pengobatan tradisional, dan biasanya dibuat dengan cara, misalnya Tradisional Chinese medicine (TCM) seringkali membutuhkan herba yang dididihkan dalam air dan dekok dalam air untuk diberikan sebagai obat. Proses ini harus ditiru sedekat mungkin jika ekstrak akan melalui kajian ilmiah biologi atau kimia lebih lanjut, khususnya jika tujuannya untuk memvalidasi penggunaan obat tradisional.
4. Sifat senyawa yang akan diisolasi belum ditentukan sebelumnya dengan cara apapun. Situasi ini (utamanya dalam program skrining) dapat timbul jika tujuannya adalah untuk menguji organisme, baik yang dipilih secara acak atau didasarkan pada penggunaan tradisional untuk mengetahui adanya senyawa dengan aktivitas biologi khusus.
Proses pengekstraksian komponen kimia dalam sel tanaman yaitu pelarut organik akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dalam pelarut organik di luar sel, maka larutan terpekat akan berdifusi keluar sel dan proses ini akan berulang terus sampai terjadi keseimbangan antara konsentrasi cairan zat aktif di dalam dan di luar sel.
3. Prinsip ekstraksi
Ekstraksi
adalah penyarian zat-zat aktif dari bagian tanaman obat. Adapun tujuan
dari ekstraksi yaitu untuk menarik komponen kimia yang terdapat dalam
simplisia.
2. Tujuan Ekstraksi
Tujuan
ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam
simplisia. Ekstraksi ini didasarkan pada perpindahan massa
komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi
pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut.
Secara umum, terdapat empat situasi dalam menentukan tujuan ekstraksi:
1. Senyawa kimia telah diketahui identitasnya untuk diekstraksi dari organisme. Dalam kasus ini, prosedur yang telah dipublikasikan dapat diikuti dan dibuat modifikasi yang sesuai untuk mengembangkan proses atau menyesuaikan dengan kebutuhan pemakai.
2. Bahan diperiksa untuk menemukan kelompok senyawa kimia tertentu, misalnya alkaloid, flavanoid atau saponin, meskipun struktur kimia sebetulnya dari senyawa ini bahkan keberadaannya belum diketahui. Dalam situasi seperti ini, metode umum yang dapat digunakan untuk senyawa kimia yang diminati dapat diperoleh dari pustaka. Hal ini diikuti dengan uji kimia atau kromatografik yang sesuai untuk kelompok senyawa kimia tertentu
3. Organisme (tanaman atau hewan) digunakan dalam pengobatan tradisional, dan biasanya dibuat dengan cara, misalnya Tradisional Chinese medicine (TCM) seringkali membutuhkan herba yang dididihkan dalam air dan dekok dalam air untuk diberikan sebagai obat. Proses ini harus ditiru sedekat mungkin jika ekstrak akan melalui kajian ilmiah biologi atau kimia lebih lanjut, khususnya jika tujuannya untuk memvalidasi penggunaan obat tradisional.
4. Sifat senyawa yang akan diisolasi belum ditentukan sebelumnya dengan cara apapun. Situasi ini (utamanya dalam program skrining) dapat timbul jika tujuannya adalah untuk menguji organisme, baik yang dipilih secara acak atau didasarkan pada penggunaan tradisional untuk mengetahui adanya senyawa dengan aktivitas biologi khusus.
Proses pengekstraksian komponen kimia dalam sel tanaman yaitu pelarut organik akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dalam pelarut organik di luar sel, maka larutan terpekat akan berdifusi keluar sel dan proses ini akan berulang terus sampai terjadi keseimbangan antara konsentrasi cairan zat aktif di dalam dan di luar sel.
3. Prinsip ekstraksi
· Prinsip Maserasi
Penyarian
zat aktif yang dilakukan dengan cara merendam serbuk simplisia dalam
cairan penyari yang sesuai selama tiga hari pada temperatur kamar
terlindung dari cahaya, cairan penyari akan masuk ke dalam sel melewati
dinding sel. Isi sel akan larut karena adanya perbedaan konsentrasi antara larutan di
dalam sel dengan di luar sel. Larutan yang konsentrasinya tinggi akan
terdesak keluar dan diganti oleh cairan penyari dengan konsentrasi
rendah ( proses difusi ). Peristiwa tersebut berulang sampai terjadi
keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel.
Selama proses maserasi dilakukan pengadukan dan penggantian cairan
penyari setiap hari. Endapan yang diperoleh dipisahkan dan filtratnya
dipekatkan.
· Prinsip Perkolasi
Penyarian zat aktif yang dilakukan dengan cara serbuk simplisia dimaserasi selama
3 jam, kemudian simplisia dipindahkan ke dalam bejana silinder yang
bagian bawahnya diberi sekat berpori, cairan penyari dialirkan dari atas
ke bawah melalui simplisia tersebut, cairan penyari akan melarutkan zat
aktif dalam sel-sel simplisia yang dilalui sampai keadan jenuh. Gerakan
ke bawah disebabkan oleh karena gravitasi, kohesi, dan berat cairan di
atas dikurangi gaya kapiler yang menahan gerakan ke bawah. Perkolat yang
diperoleh dikumpulkan, lalu dipekatkan.
· Prinsip Soxhletasi
Penarikan
komponen kimia yang dilakukan dengan cara serbuk simplisia ditempatkan
dalam klonsong yang telah dilapisi kertas saring sedemikian rupa, cairan
penyari dipanaskan dalam labu alas bulat sehingga menguap dan
dikondensasikan oleh kondensor bola menjadi molekul-molekul cairan
penyari yang jatuh ke dalam klonsong menyari zat aktif di dalam
simplisia dan jika cairan penyari telah mencapai permukaan sifon,
seluruh cairan akan turun kembali ke labu alas bulat melalui pipa
kapiler hingga terjadi sirkulasi. Ekstraksi sempurna
ditandai bila cairan di sifon tidak berwarna, tidak tampak noda jika di
KLT, atau sirkulasi telah mencapai 20-25 kali. Ekstrak yang diperoleh
dikumpulkan dan dipekatkan.
· Prinsip Refluks
Penarikan komponen kimia yang dilakukan dengan cara
sampel dimasukkan ke dalam labu alas bulat bersama-sama dengan cairan
penyari lalu dipanaskan, uap-uap cairan penyari terkondensasi pada
kondensor bola menjadi molekul-molekul cairan penyari yang akan turun
kembali menuju labu alas bulat, akan menyari kembali sampel yang berada
pada labu alas bulat, demikian seterusnya berlangsung secara
berkesinambungan sampai penyarian sempurna, penggantian pelarut
dilakukan sebanyak 3 kali setiap 3-4 jam. Filtrat yang diperoleh
dikumpulkan dan dipekatkan.
· Prinsip Destilasi Uap Air
Penyarian
minyak menguap dengan cara simplisia dan air ditempatkan dalam labu
berbeda. Air dipanaskan dan akan menguap, uap air akan masuk ke dalam
labu sampel sambil mengekstraksi minyak menguap yang terdapat dalam
simplisia, uap air dan minyak menguap yang telah terekstraksi menuju
kondensor dan akan terkondensasi, lalu akan melewati pipa alonga, campuran air dan minyak menguap akan masuk ke dalam corong pisah, dan akan memisah antara air dan minyak atsiri.
· Prinsip Rotavapor
Proses pemisahan ekstrak dari cairan penyarinya dengan pemanasan yang dipercepat oleh
putaran dari labu alas bulat, cairan penyari dapat menguap 5-10º C di
bawah titik didih pelarutnya disebabkan oleh karena adanya penurunan
tekanan. Dengan bantuan pompa vakum, uap larutan penyari akan menguap
naik ke kondensor dan mengalami kondensasi menjadi molekul-molekul
cairan pelarut murni yang ditampung dalam labu alas bulat penampung.
- Prinsip Ekstraksi Cair-Cair
Ekstraksi
cair-cair (corong pisah) merupakan pemisahan komponen kimia di antara 2
fase pelarut yang tidak saling bercampur di mana sebagian komponen
larut pada fase pertama dan sebagian larut pada fase kedua, lalu kedua
fase yang mengandung zat terdispersi dikocok, lalu didiamkan sampai
terjadi pemisahan sempurna dan terbentuk dua lapisan fase cair, dan
komponen kimia akan terpisah ke dalam kedua fase tersebut sesuai dengan
tingkat kepolarannya dengan perbandingan konsentrasi yang tetap.
- Prinsip Kromatografi Lapis Tipis
Pemisahan komponen kimia berdasarkan prinsip adsorbsi dan partisi, yang ditentukan oleh fase diam (adsorben) dan fase gerak (eluen), komponen
kimia bergerak naik mengikuti fase gerak karena daya serap adsorben
terhadap komponen-komponen kimia tidak sama sehingga komponen kimia
dapat bergerak dengan kecepatan yang berbeda berdasarkan tingkat
kepolarannya, hal inilah yang menyebabkan terjadinya pemisahan.
- Prinsip Penampakan Noda
a. Pada UV 254 nm
Pada
UV 254 nm, lempeng akan berflouresensi sedangkan sampel akan tampak
berwarna gelap.Penampakan noda pada lampu UV 254 nm adalah karena adanya
daya interaksi antara sinar UV dengan indikator fluoresensi yang
terdapat pada lempeng. Fluoresensi cahaya yang tampak merupakan emisi
cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang
tereksitasi dari tingkat energi dasar ke tingkat energi yang lebih
tinggi kemudian kembali ke keadaan semula sambil melepaskan energi.
b. Pada UV 366 nm
Pada
UV 366 nm noda akan berflouresensi dan lempeng akan berwarna gelap.
Penampakan noda pada lampu UV 366 nm adalah karena adanya daya interaksi
antara sinar UV dengan gugus kromofor yang terikat oleh auksokrom yang
ada pada noda tersebut. Fluoresensi cahaya yang tampak merupakan emisi
cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang
tereksitasi dari tingkat energi dasar ke tingkat energi yang lebih
tinggi kemudian kembali ke keadaan semula sambil melepaskan energi.
Sehingga noda yang tampak pada lampu UV 366 terlihat terang karena silika gel yang digunakan tidak berfluororesensi pada sinar UV 366 nm.
c. Pereaksi Semprot H2SO4 10%
Prinsip penampakan noda pereaksi semprot H2SO4 10%
adalah berdasarkan kemampuan asam sulfat yang bersifat reduktor dalam
merusak gugus kromofor dari zat aktif simplisia sehingga panjang
gelombangnya akan bergeser ke arah yang lebih panjang (UV menjadi VIS)
sehingga noda menjadi tampak oleh mata.
4. Jenis Ekstraksi
- Ekstraksi secara dingin
· Metode maserasi
Maserasi
merupakan cara penyarian sederhana yang dilakukan dengan cara merendam
serbuk simplisia dalam cairan penyari selama beberapa hari pada
temperatur kamar dan terlindung dari cahaya.
Metode
maserasi digunakan untuk menyari simplisia yang mengandung komonen
kimia yang mudah larut dalam cairan penyari, tidak mengandung benzoin,
tiraks dan lilin.
Keuntungan
dari metode ini adalah peralatannya sederhana. Sedang kerugiannya
antara lain waktu yang diperlukan untuk mengekstraksi sampel cukup lama,
cairan penyari yang digunakan lebih banyak, tidak dapat digunakan untuk
bahan-bahan yang mempunyai tekstur keras seperti benzoin, tiraks dan
lilin.
Metode maserasi dapat dilakukan dengan modifikasi sebagai berikut :
· Modifikasi maserasi melingkar
· Modifikasi maserasi digesti
· Modifikasi Maserasi Melingkar Bertingkat
· Modifikasi remaserasi
· Modifikasi dengan mesin pengaduk
· Metode Soxhletasi
Soxhletasi
merupakan penyarian simplisia secara berkesinambungan, cairan penyari
dipanaskan sehingga menguap, uap cairan penyari terkondensasi menjadi
molekul-molekul air oleh pendingin balik dan turun menyari simplisia
dalam klongsong dan selanjutnya masuk kembali ke dalam labu alas bulat
setelah melewati pipa sifon
Keuntungan metode ini adalah :
- Dapat digunakan untuk sampel dengan tekstur yang lunak dan tidak tahan terhadap pemanasan secara langsung.
- Digunakan pelarut yang lebih sedikit
- Pemanasannya dapat diatur
Kerugian dari metode ini :
- Karena pelarut didaur ulang, ekstrak yang terkumpul pada wadah di sebelah bawah terus-menerus dipanaskan sehingga dapat menyebabkan reaksi peruraian oleh panas.
- Jumlah total senyawa-senyawa yang diekstraksi akan melampaui kelarutannya dalam pelarut tertentu sehingga dapat mengendap dalam wadah dan membutuhkan volume pelarut yang lebih banyak untuk melarutkannya.
- Bila dilakukan dalam skala besar, mungkin tidak cocok untuk menggunakan pelarut dengan titik didih yang terlalu tinggi, seperti metanol atau air, karena seluruh alat yang berada di bawah komdensor perlu berada pada temperatur ini untuk pergerakan uap pelarut yang efektif.
Metode
ini terbatas pada ekstraksi dengan pelarut murni atau campuran
azeotropik dan tidak dapat digunakan untuk ekstraksi dengan campuran
pelarut, misalnya heksan :diklormetan = 1 : 1, atau pelarut yang
diasamkan atau dibasakan, karena uapnya akan mempunyai komposisi yang
berbeda dalam pelarut cair di dalam wadah.
· Metode Perkolasi
Perkolasi adalah cara penyarian dengan mengalirkan penyari melalui serbuk simplisia yang telah dibasahi.Keuntungan
metode ini adalah tidak memerlukan langkah tambahan yaitu sampel padat
(marc) telah terpisah dari ekstrak. Kerugiannya adalah kontak antara
sampel padat tidak merata atau terbatas dibandingkan dengan metode
refluks, dan pelarut menjadi dingin selama proses perkolasi sehingga
tidak melarutkan komponen secara efisien.
2. Ekstraksi secara panas
· Metode refluks
Keuntungan
dari metode ini adalah digunakan untuk mengekstraksi sampel-sampel yang
mempunyai tekstur kasar dan tahan pemanasan langsung..
Kerugiannya adalah membutuhkan volume total pelarut yang besar dan sejumlah manipulasi dari operator.
· Metode destilasi uap
Destilasi uap adalah metode yang popular untuk ekstraksi minyak-minyak menguap (esensial) dari sampel tanaman
Metode
destilasi uap air diperuntukkan untuk menyari simplisia yang mengandung
minyak menguap atau mengandung komponen kimia yang mempunyai titik
didih tinggi pada tekanan udara normal.
Sumber :
- Ditjen POM, (1986), "Sediaan Galenik", Departemen Kesehatan Republik Indonesia, Jakarta.
- Wijaya H. M. Hembing (1992), ”Tanaman Berkhasiat Obat di Indonesia”, Cet 1 , Jakarta .
- Sudjadi, Drs., (1986), "Metode Pemisahan", UGM Press, Yogyakarta
- Alam, Gemini dan Abdul Rahim. 2007. Penuntun Praktikum Fitokimia. UIN
- Alauddin: Makassar. 24-26.
- Stahl, Egon. 1985. Analisis Obat Secara Kromatografi dan Mikroskopi. ITB: Bandung. 3-5.
Label:
kimia farmasi,
obat,
sediaan farmasi,
umum,
zat kimia berbahaya
Langganan:
Komentar (Atom)